1 引 言
2 材料与方法
2.1 材料
表1 纳米磷灰石和水铁矿中稀土元素含量 (g/kg)Table 1 Rare Earth Element (REE) content of apatite and ferrihydrite |
| 矿物 | La | Ce | Pr | Nd | Sm | Eu | Gd |
|---|---|---|---|---|---|---|---|
| 纳米磷灰石 | 1.737 | 1.693 | 1.616 | 1.531 | 1.478 | 1.634 | 1.666 |
| 水铁矿 | 1.855 | 1.831 | 1.753 | 1.813 | 1.615 | 1.769 | 1.802 |
| 矿物 | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| 纳米磷灰石 | 1.607 | 1.632 | 1.579 | 1.640 | 1.601 | 1.649 | 1.604 |
| 水铁矿 | 1.742 | 1.775 | 1.731 | 1.795 | 1.756 | 1.813 | 1.752 |
2.2 实验
2.3 分析测试
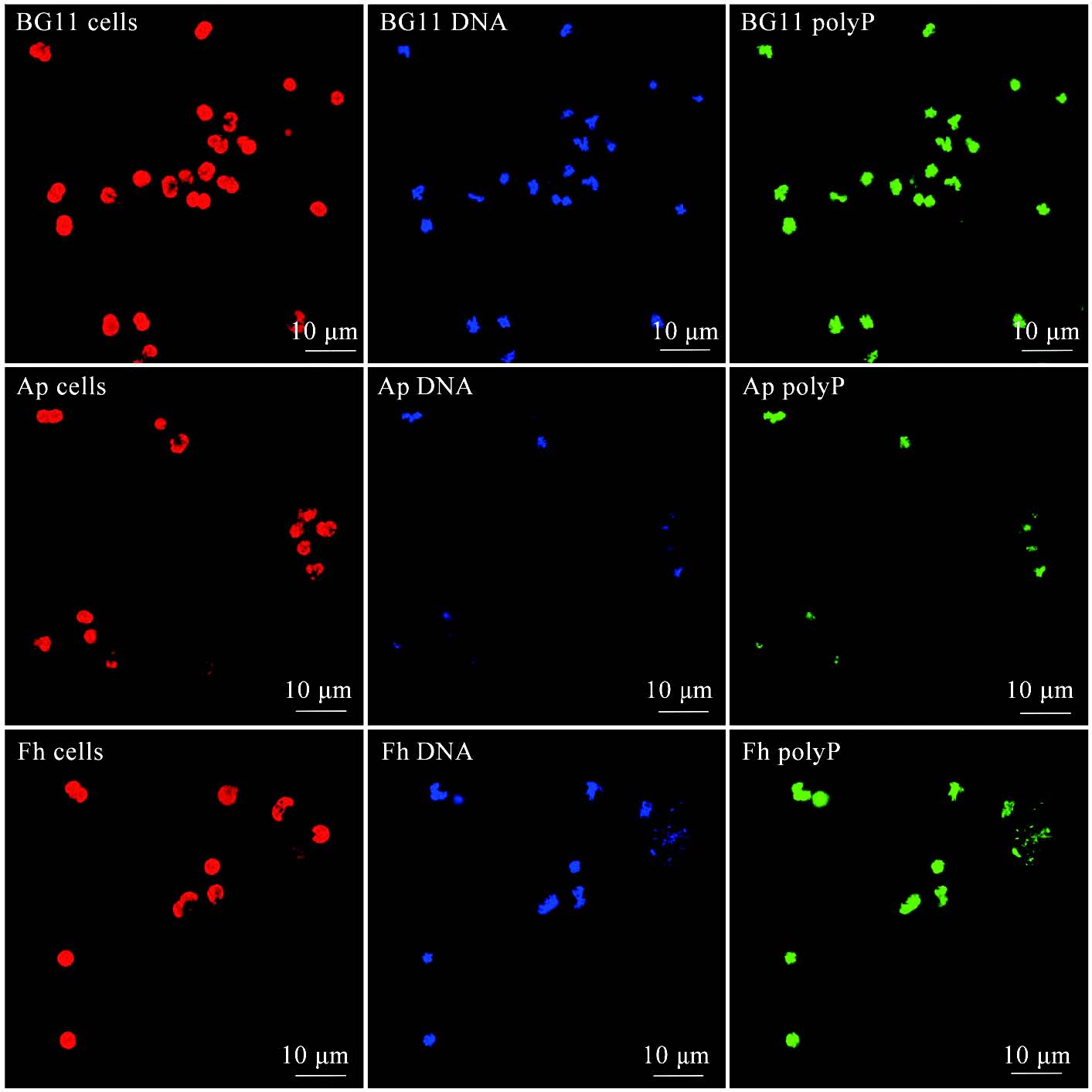
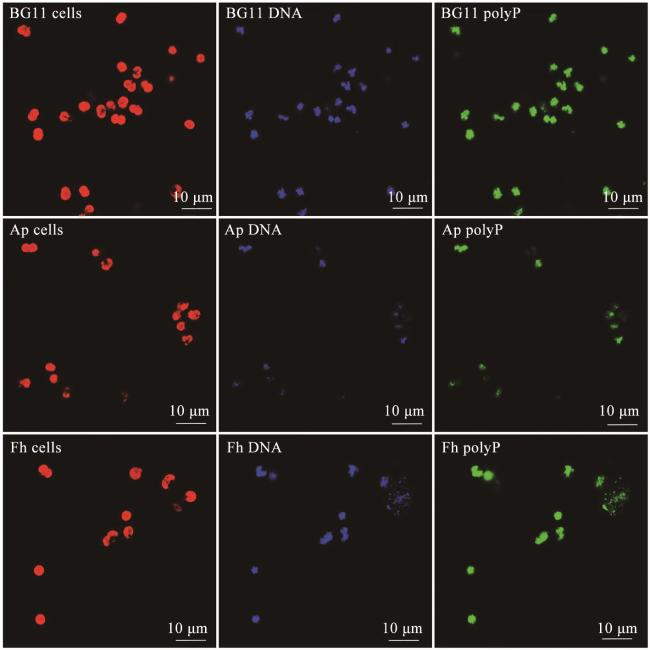
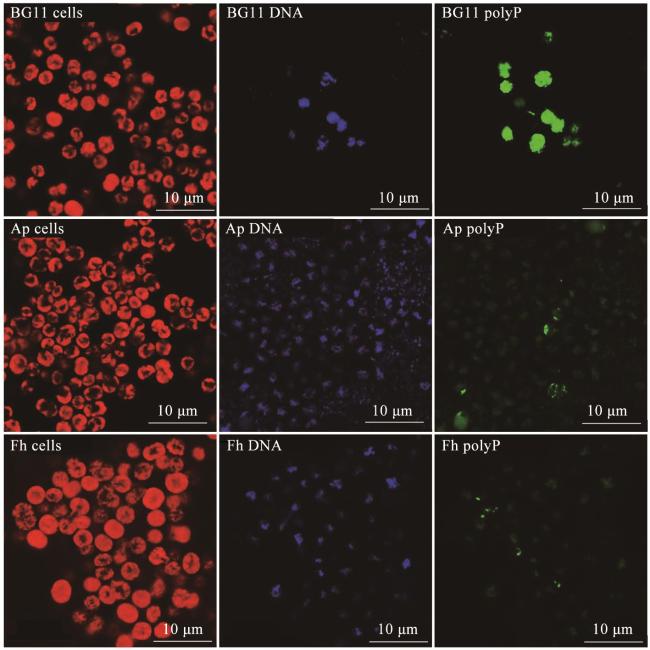
2.3.1 DAPI荧光染色分析
2.3.2 固体核磁共振分析
2.3.3 ICP-MS分析
2.3.4 HRTEM分析
3 结 果
3.1 DAPI荧光染色
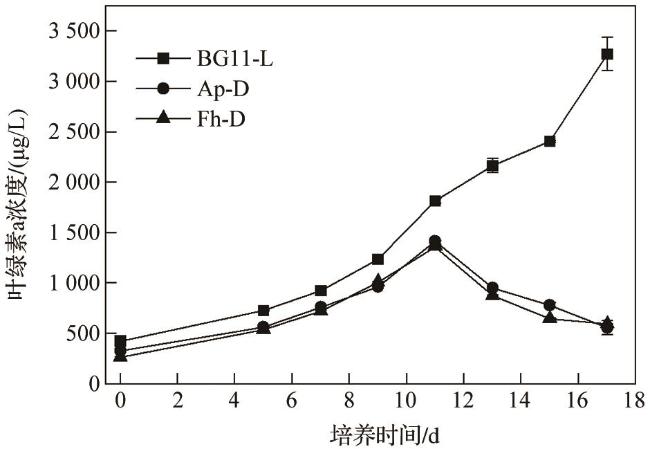
3.2 生长曲线
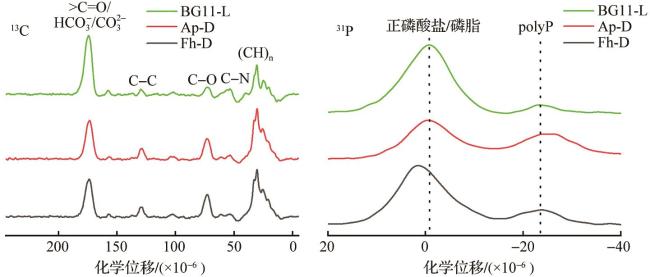
3.3 固体核磁共振
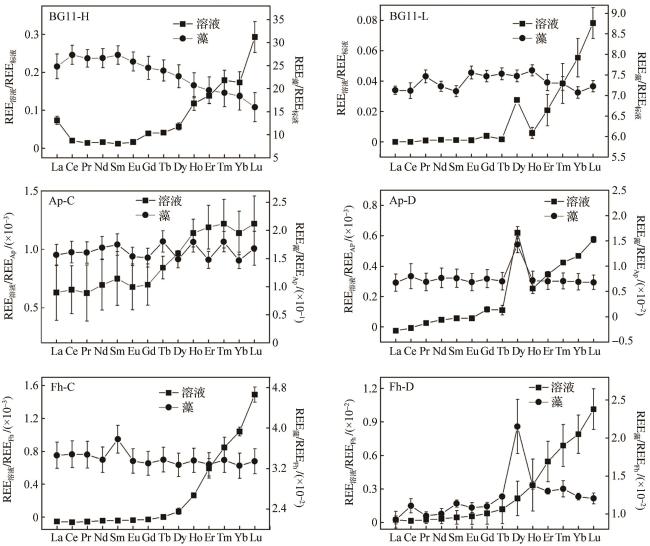
3.4 稀土元素浓度
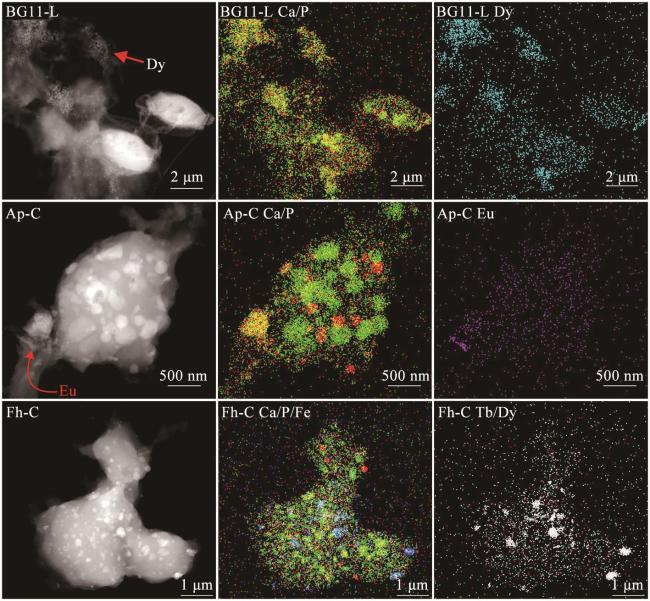
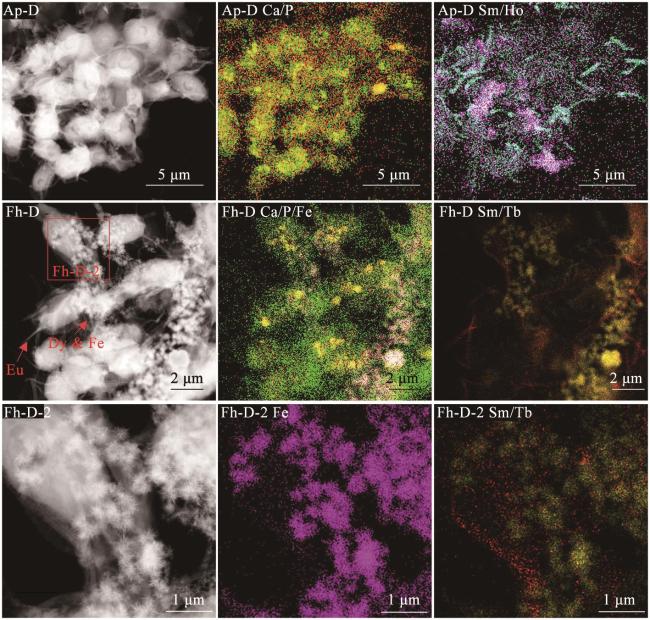
3.5 微区形貌和成分分析
图7 透析实验中细胞高角环形暗场像图和元素微区分布图红色: P或Sm;绿色:Ca;粉红色:Fe或Ho;浅蓝色:Sm;黄色:Tb;Ca/P分布图中的黄色为红色与绿色叠加后的颜色。 Fig. 7 High-Angle Annular Dark Field (HAADF) images and element distribution maps of cells in dialysis experiments Red: P or Sm; Green: Ca; Pink: Fe or Ho; aquamarine: Sm; yellow: Tb; yellow color in Ca/P distribution maps is derived from the stacking of red and green colors. |









 甘公网安备62010202000687
甘公网安备62010202000687