作者简介:任成喆(1991-),男,吉林白城人,博士研究生,主要从事海洋生物地球化学研究.E-mail:renchengzhe@outlook.com
氨基糖作为海洋环境中一类具有重要地球化学特征的有机质,其在海水、颗粒物和沉积物中的含量和组成等信息能够有效反映有机质的来源、降解过程及成岩状态。从氨基糖的来源与组成、海洋环境中的分布特征和影响因素,以及其作为生物标志物对有机质来源和降解状态的指示作用等方面,系统总结了海洋环境中氨基糖的研究进展。结果表明,氨基糖的活性受其大分子形态、环境中溶解氧、营养盐水平和沉积环境的影响。葡萄糖胺/半乳糖胺(GlcN/GalN)和总可水解氨基酸/总可水解氨基糖(THAA/THAS)对有机质来源和降解状态的指示具有一致性,较高的GlcN/GalN和THAA/THAS值可反映浮游生物来源的新鲜有机质,其比值的降低表明有机质逐渐向细菌有机质转化。氨基糖的碳、氮归一化含量对二者的指示具有差异性,其比例的升高和降低取决于有机质降解程度和来源影响的相对贡献大小。胞壁酸可用于估算较为新鲜的细菌有机质对总有机质的贡献,但由于其快速循环而导致在溶解有机质中的含量极低,不适合应用在溶解有机质中。今后的工作应进一步加强不同微生物对海洋环境中氨基糖的贡献,区分有机质来源和降解对氨基糖的影响以及转化和归宿研究。
First author:Ren Chengzhe (1991-), male, Baicheng County, Jilin Province, Ph.D studernt. Research areas include marine biogeochemistry.E-mail:renchengzhe@outlook.com
As a kind of marine organic matter with important geochemical characteristics, amino sugars can effectively reflect the source, diagenetic state and mineralization process of organic matter by their concentration and composition in marine environment. This article systematically concluded the research progresses of amino sugars from the aspects of their source, composition and distribution characteristics in marine environment, and the role as a biomarker indicating source and diagenetic state of marine organic matter. The result showed that the macromolecular morphology, the oxygen and nutrient level and the sedimentary environment could affect the reactivity of amino sugars. The higher ratios of glucosamine to galactosamine (GlcN/GalN) and the Total Hydrolysable Amino Acids to Total Hydrolysable Amino Sugars (THAA/THAS) can reflect the fresh planktonic organic matter source and the lower ratios can reflect the conversion from planktonic to bacterial organic matter. The carbon and nitrogen normalized yield of total hydrolysable amino sugars, however, could give contradictory results depending on the relative contribution of the source and degradation degree of organic matter. Muramic acid is suitable to estimate the contribution of relatively fresh bacteria organic matter to particulate and sediment organic matter, but it is not suitable for applying in the dissolved organic matter because of its very low concentration leading from its rapid recycle. It is critical to enhance the research on the contribution of different microorganisms to amino sugars and differentiate the influence of organic matter source and degradation on amino sugars in marine environment. The research on the conversion and fate of amino sugars in marine environment is also needed.
海洋系统对地球生物圈贡献了44~50 GtC/a的新有机质, 其量级与陆地系统对生物圈的贡献大致相当[1]。海洋有机质的循环是海洋环境中重要的生物地球化学过程[2], 与碳、氮、氧等海洋重要的生源要素及海洋矿物[3]的生物地球化学循环密不可分[4]。有机质的成岩矿化是碳和营养盐循环的主要驱动力[5]。有机质的组成、区域沉积环境的差异、有机质的保存与矿化的调节过程是影响海洋有机质循环的重要因素[6]。在颗粒有机物的垂向沉降和迁移过程中, 有机质经历了选择性的降解过程, 其中生源活性有机质如氨基酸、糖、脂类物质等易被分解代谢而消耗, 而一些惰性有机质会富集于深层海洋的颗粒中或沉降到沉积物中。与此同时, 异养微生物会合成新的有机物并结合进入颗粒物中。深入研究有机质的生物活性、矿化过程及控制因素, 定量评估异养细菌对有机质的降解和迁移转化作用, 可为深入研究有机质与生源要素的循环过程奠定基础。
氨基糖(Amino Sugar, AS)是几丁质、肽聚糖等生物大分子的基本组成单元, 其中葡萄糖胺(Glucosamine, GlcN)和半乳糖胺(Galactosamine, GalN)广泛存在于浮游生物及细菌有机质中, 胞壁酸(Muramic Acid, MurA)仅存在于细菌细胞壁的肽聚糖中。在海洋颗粒有机物(Particulate Organic Matter, POM)中氨基糖占有机碳的0.2%~2.1%, 有机氮的0.5%~2.8%; 在溶解有机物(Dissolved Organic Matter, DOM)中占有机碳的0.2%~1.2%, 有机氮的0.7%~3.3% (表1)。氨基糖在有机物中的组成、结构和分布等赋存特征对于了解有机质的来源、组成和迁移转化等生物地球化学过程具有重要指示意义。本文综述了海洋环境中氨基糖研究的现状, 着重介绍了氨基糖的来源与组成、在海洋环境中的分布特征和影响因素, 以及其作为生物标志物对有机质来源和降解状态的指示作用, 并探讨了该领域研究中存在的问题。
| 表1 海洋DOM, UDOM, POM, SOM和沉降颗粒物中氨基糖的分布 Table 1 The distribution of AS in marine DOM, UDOM, POM, SOM and settling particulate matter |
GlcN和GalN是海洋中含量最丰富的2种氨基糖, 在海洋POM, DOM和沉积有机质(Sediment Organic Matter, SOM)中约占总可水解氨基糖(Total Hydrolysable Amino Sugar, THAS)的90%[8, 17, 19]。它们广泛存在于藻类、细菌、古菌及无脊椎动物体内, 生物大分子来源有几丁质、肽聚糖、糖蛋白、糖脂、黏多糖、假肽聚糖和脂多糖等[8, 22~24]。
MurA是细菌特有的氨基糖, 仅存在于细菌细胞壁的肽聚糖中, 在海洋DOM, POM和SOM中占THAS的1%~4%[8, 17, 19]。肽聚糖是细菌细胞壁的主要成分之一, 由乙酰葡萄糖胺和乙酰胞壁酸交替构成的多糖链和由氨基酸(Amino Acid, AA)组成的多肽侧链共价交联而成[25]。
甘露糖胺(Mannosamine, ManN)广泛存在于藻类和细菌产物中[8], 是膜糖脂中唾液酸的结构骨架, 在海洋沉积物中占THAS的6%~14%[26]。尽管其含量较低, 且来源不具有专一性, 但在对氨基糖总量的研究中仍然不可忽略。
以往研究对生物体中氨基糖含量的直接测定较少, 并且相隔年代较久, 所使用的测定方法和测定物种都不尽相同(表2)。在实验室培养的生物体中, AS的碳、氮归一化含量(%THAS-TOC, %THAS-TN)大小顺序为桡足类> 细菌> 藻类, 分别约为12, 0.3~3.9, 0.1~0.5和7, 0.3~2.5, 0.2~0.6。GlcN和GalN在经检测的生物体中含量最高, 但在不同生物体中二者的比例存在差异。桡足类具有几丁质外骨骼, 其GlcN含量非常高, 因此GlcN/GalN较高(14.2~20.9)。海洋细菌的GlcN/GalN较低(1.6~3.4), 明显低于桡足类和藻类。由于GlcN/GalN在含几丁质生物和海洋细菌中差异较大, 因此有助于判断海洋有机质的来源。ManN广泛存在于生物体内, 但含量较低。MurA仅在细菌中检出, 且含量差异较大, 由于革兰氏阳性菌(G+细菌)细胞壁较厚, 其MurA可达革兰氏阴性菌(G-细菌)的5~10倍。
AS广泛存在于海洋浮游生物和细菌中, 但目前仍无法确定其主要的生物大分子来源。几丁质是由GlcN构成的聚合物, 是海洋中GlcN的重要来源之一, 可由多种海洋有机体产生, 如海洋无脊椎动物的外骨骼[30~32]、原生动物[33~35]、藻类(绿藻的细胞壁[36, 37]、硅藻的刺[38]和金藻的柄[39])等。据估算, 海洋中仅节肢动物的几丁质产量即可达1 328× 106 t/a[40]。据Kirchman等[41]估算, 几丁质可支持约10%的海洋细菌产量。尽管几丁质可能是GlcN的主要来源, 但是多数海洋POM, DOM及沉积物样品中GlcN/GalN≤ 2, 表明细菌有机质对AS具有主要贡献[8, 11, 20, 26]。肽聚糖是细菌细胞壁的主要成分, 是MurA已知的唯一来源, 但并不是海洋GlcN的主要来源。 肽聚糖中GlcN/MurA=1, 而颗粒态细菌有机质的GlcN/MurA值为6~15[42], 说明细菌中大部分GlcN并不是由肽聚糖产生。在海洋POM和超滤溶解有机质UDOM (Ultrafiltered Dissolved Organic Matter) 中, 较高的GlcN/MurA值同样表明肽聚糖不是其中GlcN的主要来源[8]。除肽聚糖外, 其他细菌细胞壁物质如糖蛋白、胞外聚合物、抗生素和脂多糖, 以及古菌中的假肽聚糖中都有AS存在[22~24, 43, 44]。
| 表2 氨基糖在生物体中的组成及含量 Table 2 Concentration and composition of AS in some organisms |
AS是海洋有机物中较为丰富的组分。在POM和DOM中, AS含量为1~100 nmol/L, 在沉降颗粒物和SOM中, AS含量为1~40 μ mol/(g dw)。在DOM, POM, SOM和沉降颗粒物中, AS占总有机碳和总氮的1%~4%(表1)。作为糖类中唯一的含氮组分, AS对总氮的贡献略高于对总有机碳的贡献。
AS的组成、含量以及%THAS-TOC和%THAS-TN在不同形态的海洋有机质中有所不同。AS在DOM和UDOM中的含量及%THAS-TOC和%THAS-TN比在POM中要高, 而GlcN/GalN值在POM中低(图1)。在沉降颗粒物中, GlcN/GalN> 3, 明显高于DOM, POM和SOM(< 3)(表1)。
AS的垂直分布趋势在DOM和POM中较为一致, 表现为AS在表层含量最高, 随深度增加, AS各项指标(THAS, %THAS-TOC, %THAS-TN和GlcN/GalN)均呈下降趋势, 其中在上层下降最为显著(< 300 m)(图2, 图3)。
 | 图2 太平洋POM(0.1~60 μ m)中AS的垂直变化(数据来自参考文献[8])Fig.2 Vertical changes of AS in POM(0.1~60 μ m)of Pacific Ocean(data from reference[8]) |
 | 图3 太平洋UDOM(< 0.1 μ m)中AS的垂直变化(数据来自参考文献[8])Fig.3 Vertical changes of AS in UDOM(< 0.1 μ m) of Pacific Ocean(data from reference[8]) |
在4种AS中, GlcN和GalN的降解趋势较为一致。THAS的活性主要取决于含量最丰富的GlcN和GalN, 因为MurA和ManN至多占THAS的16%[8, 19, 20]。因此, GlcN和GalN与THAS的降解趋势也是一致的。而MurA虽然同样在表层高于深层, 但其降解趋势与GlcN和GalN有所不同。MurA仅存于细菌细胞壁, 而GlcN和GalN有多种生物来源。并且MurA比GlcN和GalN活性高, 来源和活性的不同可能是导致MurA与GlcN和GalN降解趋势不同的主要原因。
在沉降颗粒物中, 受降解作用影响, THAS随深度增加而降低, 同时细菌有机质逐渐取代几丁质而成为AS的重要来源, 导致GlcN/GalN也随深度增加而降低。%THAS-TOC和%THAS-TN没有一致的变化趋势。在一些研究中, 沉降颗粒物的%THAS-TOC和%THAS-TN随深度增加略有降低, 如日本大槌湾(图4)和赤道太平洋(图5); 而在另一些研究中, 沉降颗粒物的%THAS-TOC和%THAS-TN随深度增加有所升高, 如楚科奇海和日本喷火湾(图4)。
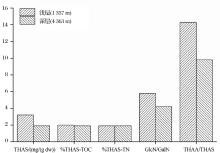
在海洋表层沉积物中, THAS, %THAS-TOC和GlcN/GalN随沉积深度增加而下降, 如秘鲁沉积物29MC和81MC站位。但是表层沉积物容易受到上层水体及底栖生物扰动的影响。如秘鲁沉积物71MC站位受上层水体扰动的影响, 相比于29MC和81MC, 其AS在50 cm深度内较为均一, 没有明显的降低(图6)。
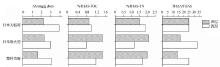 | 图4 近海及海湾沉降颗粒物中氨基糖的垂直变化(数据来自参考文献[15])Fig.4 Vertical changes of AS in settling particulate matter of coastal area and bays (data from reference[15]) |
 | 图5 赤道太平洋沉降颗粒物中氨基糖的垂直变化(数据来自参考文献[11])Fig.5 Vertical changes of AS in settling particulate matter of equatorial pacific(data from reference[11]) |
氨基糖是海洋中活性较高的有机质, 在POM, DOM, UDOM和SOM中, AS含量和%THAS-TOC, %THAS-TN均随水深或沉积物深度增加而下降。但在沉降颗粒物中, 却发现AS随水深增加%THAS-TOC和%THAS-TN升高的现象(图4)。一般认为, AS是海洋中活性较高的有机质, 其活性高于TOC, 相比于TOC优先降解。作者认为, TOC和TN的活性取决于其中处于动态平衡的有机质组成, 随着降解的不断进行, 活性较高的有机质不断消耗, 活性较低的有机质相对累积, 使TOC和TN的活性不断下降。AA等有机质的活性和碳、氮归一化含量比AS更高, 在降解早期对TOC和TN的活性影响较大。由于这些活性更高的有机质优先降解, 可能导致在降解初期TOC和TN的活性高于AS。DOM和POM在水体中停留时间较长, AA等活性有机质有充足时间降解, 在这之后表现为AS的活性高于TOC和TN, 因此随深度增加%THAS-TOC和%THAS-TN呈下降趋势。而沉降颗粒物在水体中停留时间相对较短, AA尚未有充足的时间降解, 其对TOC和TN活性的影响仍然较大。因此TOC和TN的活性仍然高于AS, 表现为随深度增加%THAS-TOC和%THAS-TN的升高。
Kawasaki等[42]对海洋细菌进行培养实验发现, POM中GlcN和GalN降解速率均明显低于MurA。MurA和细菌, 总可水解氨基酸(Total Hydrolysable Amino Acids, THAA)的降解速率没有显著差异(0.10~0.13 d-1)。Lomstein等[17]发现秘鲁沿海表层沉积物中, GlcN/THAA和GalN/THAA与水深呈正相关, 而MurA/THAA与水深呈负相关, 说明POM中的GlcN和GalN相比于THAA更易保存, 而MurA相比于THAA更易降解[8, 44]。考虑到GlcN/GalN在不同海域, 不同深度, 无论是水体或沉积物中大多保持较稳定的数值(1~3)(表1), 二者的降解速率可能并不会有较大差异。
综上, 海洋新鲜有机质中THAA和MurA的活性高于GlcN和GalN。并且由于GlcN和GalN占据了THAS的绝大部分, 因此, THAA和MurA的活性也高于THAS。TOC和TN的活性取决于有机质的降解程度, 一般在POM和DOM中, AS活性高于TOC, 在较为新鲜的沉降颗粒物中, AS的活性有可能低于TOC。
在细菌培养实验中, 随着细菌生长进入平台期, 颗粒态AA和颗粒态AS含量降低, 而溶解态AA和溶解态AS含量升高, 说明颗粒态AS在降解过程中可转化为溶解态[42]。
Nagata等[45]利用同位素示踪法检测到在肽聚糖的降解过程中, 一部分乙酰葡糖胺转化成为细菌中的乙酰胞壁酸, 说明了生物代谢过程中, 不同的AS之间可以相互转化。另外还有一大部分降解的肽聚糖成为无法识别其分子形态的低分子量(Low Molecular Weight, LMW)物质, 并且这些LMW物质主要来源于肽聚糖中的糖链, 即MurA和GlcN。但对于这些LMW物质的产生过程, 化学形态及活性尚缺乏研究。这部分有机质可能是海洋惰性有机质的重要组成部分, 由于其分子形态无法识别, 可能导致海洋细菌有机质对总有机碳库的贡献被低估。
总体来说, 目前对海洋环境中AS的生物化学转化研究较少, 利用同位素示踪法对AS的降解、转化过程进行研究, 将成为今后该领域研究的重点。
4.3.1 大分子形态对AS降解的影响
AS在海洋环境中主要以几丁质和细菌细胞壁物质等形式存在, 其大分子形态对氨基糖的降解具有重要影响。形态完好的灭活细菌在降解过程中, G+细菌(Bacillus sp.)细胞结构出现了破裂和损失, 发生了明显的降解, 而G-细菌(Erythrobacter sp.)细胞在69天的实验中始终保持完好的细胞形态, 没有明显的降解。G-细菌的细胞壁肽聚糖外层包裹着由脂多糖和蛋白质组成的外膜, 而G+细菌则没有这层外膜, 这可能使G-细菌更能抵抗降解, 从而对AS实现更好的保存。而在破碎的细菌细胞壁物质的降解过程中, G+细菌细胞壁物质的GlcN在8天内降解了89%, 而2种G-细菌细胞壁物质的GlcN在8天内降解了69%和65%, 一方面说明革兰氏阳性菌的细胞壁物质仍然比革兰氏阴性菌的细胞壁物质降解慢, 另一方面也表明破碎的细胞比形态完好的细胞更容易降解。另外, 实验中并未检测到单体形态的D-AA和GlcN, 说明一旦AS降解为自由态, 将迅速被细菌利用[46]。
几丁质是乙酰葡糖胺构成的结构聚合物, 在无脊椎动物的角质层当中与蛋白质结合, 较难降解, 而一旦这层起保护作用的外壳丢失, 多糖组分很容易被酶水解[47, 48]。利用楚科奇海表层水进行的现场培养实验中, 96%的几丁质颗粒在70天内降解[7]。由于几丁质快速降解的特点, 使其无法有效保存GlcN, 使其成为海洋异养细菌重要的碳源和氮源[48]。
因此可以认为AS的活性与其赋存的大分子形态密切相关。具有完整细胞结构的死亡细菌等微生物有机质中, AS与其他大分子物质相结合紧密, 受到很好的保护, 使其中的氨基糖降解缓慢。生物有机质破碎程度越高, AS在海水中暴露面积越大, 与大分子结合的形态越容易被打破, AS越容易降解。而未与任何生物大分子相结合的自由态AS由于未受任何保护, 降解最快。
4.3.2 溶解氧对氨基糖降解过程的影响
Niggemann等[26]发现处于水体氧最小值区域(Organic Minimal Zone, OMZ)中心的秘鲁沉积物中(71MC)AS含量在整个柱状样中高于其他2个站位(29MC, 81MC)(图6)。根据Benner等[8]对热带太平洋POM中AS的测定结果, 处于氧最小值区域(375~400 m)的GlcN和GalN含量未随深度下降而减小, 反而有微弱升高, 其%THAS-TOC和%THAS-TN也有所增加(图2)。说明在缺氧条件下, POM和SOM中AS的保存能力增强, 这与有机质在低氧条件下更易保存的认识一致。
4.3.3 营养盐对氨基糖降解过程的影响
在淡水和海洋环境中, 细菌对无机盐有显著的利用, 对无机磷的利用可达总生物利用的60%, 对无机氮的利用可达总生物利用的30%[49]。浮游植物的几丁质和细菌细胞壁成分是海洋中AS的重要来源, 且AS组成具有不同的特征, 因而营养盐水平通过影响海洋细菌和浮游生物之间的关系, 对海洋AS的产生和降解也定会产生影响。但究竟其影响机制和程度如何, 如何利用AS来反映营养盐对细菌和藻类的影响, 目前仍缺乏研究。
陆地环境中无机氮的含量可以影响细菌对植物来源有机质的降解。Ding等[50]利用15N研究不同无机氮条件下土壤细菌对玉米有机质降解的影响, 发现在降解早期阶段, 相比于低含量无机氮, 高含量的无机氮对玉米残体向微生物AS的转化产生抑制, 但在降解后期, 则由抑制变为促进作用。一方面, 高含量的无机氮可能抑制细菌对有机氮的同化, 另一方面, 在有机氮含量较低的条件下, 无机氮可能为细菌胞外酶提供氮源, 以降解有机质。尽管研究基于陆地土壤, 但海洋环境, 尤其是沉积物中是否也有类似的现象, 其背后的机理究竟是什么, 仍有待探索。
4.3.4 沉积环境对AS降解的影响
河口区域水深较浅, 生产力旺盛, 有机质的沉积速率高。颗粒物中的AS作为活性较高的有机质, 可能在水体中未经过充分降解即进入到沉积环境中, 导致表层沉积物中AS的含量可能比近底层颗粒物更高。而河口同时又是水动力条件复杂的区域, 表层沉积物易受到再悬浮的影响, 从而使其中的AS再次被矿化, 并且由于水体的搅动, 使底层水体和表层沉积物中的AS在一定深度内可能出现均匀的垂直分布。
GlcN和GalN是海洋中含量最丰富的2种氨基糖, 这2种氨基糖的含量和比例在不同的生物体中差别较大。纯几丁质中, GlcN/GalN相对较高(> 8), 随降解过程进行, 比率不断降低, 当比率低于2时可以认为是成岩改造的结果, 表征了有机质的细菌来源[8, 42, 51]。
由于GlcN/GalN在不同生物体中存在差异, 因此可以反映有机质的来源。沉降颗粒物的GlcN/GalN较高(> 3), 表明其有机质中几丁质含量较高。而DOM, POM和SOM中的GlcN/GalN一般小于2, 说明其中有机质主要是细菌来源。在西北冰洋, GlcN/GalN在POM中高于DOM, 表明了有机质来源逐渐向异养细菌转化的过程; 在太平洋海区, GlcN/GalN在POM中高于UDOM, UDOM中几乎不含有细菌, 其氨基糖来源可能是细菌残体或细菌胞外释放, 也具有低GlcN/GalN的特点(图1)。
GlcN/GalN也可以反映有机质的降解程度。在同一水柱中, 随着水深的增加, POM和DOM中的GlcN/GalN一般呈下降趋势(图2和图3)。一方面, 在降解过程中几丁质等浮游生物来源的有机质逐渐向细菌有机质转化, 导致GlcN/GalN降低; 另一方面, GlcN活性可能比GalN略高[42], 随着水深增加, GlcN优先降解, 导致GlcN/GalN降低, 但这可能是影响GlcN/GalN变化的次要因素, 因为一般认为GlcN和GalN的活性没有较大差异。此外, 有机质在降解过程中细菌可利用物质逐渐减少, 而细菌残体在细菌有机质中的比例不断增加, GlcN/GalN随水深增加而降低也可能说明了细菌残体比新鲜细菌有机质具有更低的GlcN/GalN, 但这一假设还需要进一步验证。
AS在海洋环境中的活性一般高于总有机碳库, 但低于AA[45]。基于AA和AS在降解过程中活性的差异, 可利用二者含量之比来指示有机质的“ 新鲜” 程度[11, 52]。在颗粒物沉降过程中, 随着有机质不断降解, 深层有机质比浅层有机质降解程度高, 由于AA活性高于AS, 随着降解的进行, 总可水解氨基酸/总可水解氨基糖(THAA/THAS)不断降低(图4和图5)。
另一方面, 有机质来源对THAA/THAS也有相当大的影响。新鲜浮游生物有机质中THAA/THAS为13~25, 而大部分浮游植物缺乏THAS(THAA/THAS> 80), 但含几丁质的浮游动物(THAA/THAS约为 9)、真菌细胞壁和细菌中都富含THAS[11, 53, 54]。西北冰洋表层水体(0~100 m)POM中THAA/THAS远高于DOM中的比值, 分别为73和6.2(图1), 表征了POM的浮游植物来源和DOM的细菌来源。
AS的碳、氮归一化含量同样受有机质来源和降解程度两方面因素的影响。就有机质来源方面而言, 藻类有机质中AS含量较低, 而细菌有机质中AS含量较高(表2)。就有机质降解程度方面而言, 一般认为AS相比于总有机碳、总氮优先降解, 因此其对总有机碳、总氮的贡献不断降低。
在对POM和DOM中氨基糖含量和组成的比较中发现, POM的%THAS-TOC和%THAS-TN低于DOM和UDOM。一般认为POM的降解程度低于DOM, 因此, 仅从降解角度推测, POM的%THAS-TOC和%THAS-TN应当高于DOM。相反的结果表明, 降解并不是造成POM和DOM中%THAS-TOC和%THAS-TN差异的主要因素。DOM中包含大量的细菌和细菌残体, POM中包含较多的浮游植物, 由于细菌有机质中AS的含量高于藻类有机质, 因而有机质来源可能是造成POM和DOM中%THAS-TOC和%THAS-TN差异的主要因素。
在垂向分布上, POM和DOM中%THAS-TOC, %THAS-TN均随深度的增加而下降。尽管随着降解的进行, 藻类有机质逐渐转化为细菌有机质, 但并未出现%THAS-TOC和%THAS-TN随深度增加而升高, 这说明%THAS-TOC和%THAS-TN在随深度的变化当中, 相比于有机质来源的影响, 降解因素起到更关键的作用。%THAS-TOC和%THAS-TN在浅层下降最快, 这与活性有机质在上层水体的快速循环相一致, 进一步证实了这个推测。
%THAS-TOC和%THAS-TN相比于GlcN/GalN和THAA/THAS等指标具有特殊之处。后2个指标对有机质降解程度或有机质来源的指示具有一致性, 随着降解的进行, 一方面藻类等浮游生物有机质逐渐向细菌有机质转化, 导致GlcN/GalN和THAA/THAS的降低; 另一方面GlcN比GalN降解快, THAA比THAS降解快, 也导致GlcN/GalN和THAA/THAS的降低。而%THAS-TOC和%THAS-TN对降解或有机质来源的指示具有矛盾性, 随着降解的进行, %THAS-TOC和%THAS-TN不断降低; 而随着藻类等浮游生物有机质逐渐向细菌有机质转化, %THAS-TOC和%THAS-TN升高, 具体情况下%THAS-TOC和%THAS-TN的升高或降低取决于有机质降解程度和来源哪一方面的影响更大。这种矛盾性提醒我们在利用生物标志物对有机质进行研究时, 应当注意区分来源的影响和降解的影响, 并根据具体情况分析哪一方面是主要因素, 避免一概而论, 或相互混淆, 因为二者并不总是均等和一致的。
5.4.1 利用胞壁酸估算POM和SOM中新鲜细菌有机质对有机碳库的贡献
MurA仅存于细菌细胞壁肽聚糖当中, 在肽聚糖中同时与多糖链和短肽链相连, 并存在于每一个肽聚糖亚基当中[25]。这些特征使得MurA成为细菌肽聚糖理想的生物标志物。利用公式Bacteria C or N(%)=BiomarkerOM/Biomarkerbacteria× 100可计算细菌有机质对有机碳、氮的贡献。其中, BiomarkerOM为样品中MurA的碳、氮归一化含量, Biomarkerbacteria为细菌中MurA的碳、氮归一化含量[8, 55]。
肽聚糖的活性较高, 其在海水中周转时间为10~167天, 并不是能够长期保存的细菌惰性有机质[27]。因此, MurA作为肽聚糖的生物标志物, 更适合指示新鲜细菌有机质对于海洋有机碳库的贡献[56], 其中包括活的细菌和一部分新死亡的细菌残体。细菌POM和DOM中有机质组成差异较大, 细菌在生长代谢过程中, 可向DOM中释放D型氨基酸(D-AA)等有机质, 而MurA在细菌增殖过程中, 被快速循环利用形成肽聚糖成分, 因此在DOM中含量极低(在DOM中一般低于检出限, 在UDOM中< 1 nmol/L)[8, 26, 51, 56]。所以, MurA更适合计算新鲜细菌有机质对POM和SOM的贡献, 而不适合计算细菌对DOM的贡献[57]。
通过估算, 新鲜细菌有机质对海洋有机碳的贡献为0.1%~35%, 对总氮的贡献为20%~64%(表3)。与直接利用细菌计数进行的估算相比, 以MurA估算得到的细菌有机质对总有机碳的贡献更高, 其差异甚至可达上百倍, 说明在细菌有机质当中, 死亡细菌残体对总有机碳具有主要贡献[8, 26]。细菌是海洋中非生命有机质的主要贡献者, 细菌残体在其中的贡献不可忽视。
5.4.2 细菌有机质中MurA的含量
利用MurA估算新鲜细菌有机质对总有机碳的贡献时, 确定细菌有机质MurA的含量十分关键。由于G+细菌的细胞壁比G-细菌厚, 前者的MurA含量为后者的5~10倍(表2)。海洋水体及沉积物中多数细菌为G-细菌[58, 59]。Moriarty[28]测定了实验室培养的9种陆地细菌和12种海洋细菌中MurA的含量, 得出G-细菌和弱G+细菌MurA的含量平均为12 μ g/(mg C) (48 nmol /(mg C)), G+细菌MurA平均含量为40 μ g/ (mg C)(159 nmol /(mg C))。Benner等[8]和Kaiser等[27]测定了3种海洋光合细菌、5种海洋异养细菌、7种淡水和土壤异养细菌及细菌DOM中MurA含量, 得出海洋G-细菌MurA的平均含量为(25.6± 12.9) nmol /(mg C)。二者虽然培养条件、测定菌种及测定方法等有诸多不同, 但测定结果并没有数量级的差距, 证明这些数据能够代表不同种类细菌中MurA的含量。但由于G+细菌和G-细菌中MurA含量的较大差距, 为了减小估算的误差, 应根据调查区域微生物群落的资料, 明确G+细菌和G-细菌的相对比例。
值得注意的是, Benner等[8]从外海采集的细菌实测MurA含量(3~5 nmol MurA/(mg C))显著低于实验室培养细菌(11~52 nmol MurA/(mg C)), 其差距可达10倍左右(表2)。这一现象也出现在对细菌有机碳含量的研究中, 实验室培养的细菌有机碳含量(10~260 fg C/cell)远高于天然细菌(2~24 fg C/cell)[60]。细菌纯培养环境和天然海洋环境有很大不同, 尤其是营养的供给方面, 纯培养环境的细菌比天然细菌营养充足, 个体更大[61]。这表明在以实验室培养的细菌MurA含量作为标准时, 自然条件下生长的海洋细菌MurA含量可能被高估, 因此细菌有机质对总有机质的实际贡献, 可能比目前主要基于纯培养细菌MurA含量所估算的结果更高。另一方面, 按粒径筛选的天然细菌样品中细菌细胞壁较薄, 并且细菌残体、古菌也可能混入样品中, 这些因素都可能导致环境样品MurA测定值含量偏低, 可能是导致实验室培养和天然细菌中MurA含量差异如此之大的因素之一[8]。
5.4.3 D-AA与MurA作为生物标志物的比较
D-AA是仅在细菌中含量丰富的物质, 其降解速率和细菌相似, 是细菌有机质良好的生物标志物[27]。
D-丙氨酸(D-Ala)和D-谷氨酰胺或D-谷氨酸(D-Glu)是组成肽聚糖多肽侧链中的主要氨基酸之一, 在G-菌肽聚糖中, D-Ala/MurA=0.75[25]。MurA仅存在于肽聚糖中, 而D-Ala可能有其他的细菌大分子来源, 如磷壁酸、脂多糖、脂肽和铁载体, 这些都是细菌细胞壁— 膜复合结构中的物质[27]。因而在海洋细菌中, D-Ala/MurA更高(0.7~3.6), 其中光合自养细菌比值较低(约1.1), 异养细菌比值较高(1.6~3.6)[58]。另外, 细菌胞外释放的D-Ala也是DOM的重要来源, 而MurA被细菌快速吸收利用, 在DOM中含量很低[42]。
| 表3 利用MurA和D-Ala估算细菌有机质对总有机碳、总氮的贡献 Table 3 Estimating the contribution of bacteria organic matter to TOC, TN by using MurA and D-Ala |
以D-Ala和D-Glu作为细菌有机质的生物标志物, 同样可以估算细菌有机质对总有机碳的贡献。与MurA相比, 以D-AA对POM和SOM细菌有机质进行估算的结果一般较高, 可达到以MurA估算结果的2~5倍[57, 58], 这可能是因为D-AA比MurA活性低, 因而能够代表降解程度更低的一部分细菌残体。但是在另一些研究当中, 利用D-AA和MurA估算得到了较为相似的结果[27, 29], 这可能是因为测定区域细菌有机质较为新鲜, 减小了D-AA和MurA估算的差异。
尽管氨基糖在海洋中对有机质贡献很低, 但其作为海洋中唯一含氮的碳水化合物, 其降解特性和生物来源使得它在研究海洋有机质的来源和降解状态方面有一定的研究价值, 可与基于氨基酸的指标互为补充。在海洋DOM, POM, SOM和沉降颗粒物中, AS具有不同的赋存特性, 且在垂直方向上具有明显的变化趋势。通过GlcN/GalN, THAA/THAS, %THAS-TOC, %THAS-TN等指标可以在一定程度上反映有机质的来源和降解状态, 但应当注意区分来源的影响和降解的影响, 因为二者在这些AS指标上所反映的现象可能是一致的, 但也可能是矛盾的。自由态AS活性很高, 但AS在生物有机质中通常和蛋白质等大分子结合, 使其在环境中降解变慢, 这是影响其活性的内部因素。而一些外部环境条件, 如溶解氧、营养盐水平和沉积环境等, 也能在一定程度上影响AS的降解。这些环境条件具体如何影响AS的降解过程, 如何利用AS指标反映海洋环境缺氧、富营养化、酸化等现象对有机质降解过程的影响, 是今后的研究中值得探索的问题。MurA是仅存于是细菌肽聚糖中的AS, 可用来估算新鲜细菌有机质对总有机质的贡献, 估算的结果反映了细菌残体是细菌有机质在有机质中主要的存在形式。
尽管AS已经用于反映有机质的来源和降解状态, 用于估算细菌有机质对总有机质的贡献, 但目前仍有一些基本问题没有解决。比如:尽管普遍认为细菌可能是AS在海洋中的主要来源, 但具体的大分子来源究竟是什么?实验室培养细菌和天然采集细菌的MurA含量有数量级的差别, 究竟是什么原因导致的?古菌细胞壁中含有GlcN, 其对环境中氨基糖有多大贡献?光合自养细菌是大洋重要的初级生产者, 其具有较高的GlcN/GalN, 这对于利用GlcN/GalN判断有机质来源会产生多大的干扰?如何区分有机质来源和降解对AS的影响?另外, 目前对于AS的转化和归宿也研究较少。这些问题的存在, 使AS作为反映有机质来源和降解状态的工具受到了限制。利用放射性同位素13C和3H对AS在微生物体内产生、迁移转化及降解过程的研究将成为今后对海洋环境AS研究的重要内容。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|




