作者简介:徐昭萌(1989-),男,山东济南人,博士研究生,主要从事海洋生物地球化学研究.E-mail:xuzhaomengsky@126.com
底栖有孔虫是第一种被发现能够进行反硝化的真核生物,这突破了人们对真核生物代谢方式的认识。大量研究证明底栖有孔虫对于沉积物的反硝化贡献甚至远超过原核生物,有孔虫细胞内储存大量的硝酸盐,其储量远超过间隙水中的硝酸盐,这些发现为沉积物氮循环的传统认识提出了新的挑战。有孔虫体内储存硝酸盐和反硝化的研究,对于认识真核生物在无氧环境下生存代谢的机理以及更精确地量化海洋氮收支有非常重要的意义。介绍了底栖有孔虫细胞内储存硝酸盐和反硝化的发现过程,并且对不同海区有孔虫体内储存硝酸盐和整体反硝化速率进行对比讨论,同时还总结了目前有孔虫体内储存硝酸盐和反硝化机理的最新研究进展,最后探讨了该研究领域还存在的一些问题以及需要进一步开展的工作。
First author:Xu Zhaomeng (1989- ), male, Ji’nan City, Shandong Province, Ph.D student. Research areas include oceanography and biogeochemistry.E-mail:xuzhaomengsky@126.com
Benthic foraminifera is the first kind of eukaryotes reported to carry on denitrification, which breaks the understanding of the eukaryotic metabolic way. Numerous studies have demonstrated that the contribution of benthic foraminifera to sedimentary denitrification exceeds the prokaryotes. Furthermore, benthic foraminifera stores large amount of nitrate intracellularly, which far exceeds the amount of nitrate in pore water. These findings challenge our understanding of the nitrogen cycle in sediments. The study of foraminiferal intracellular nitrate storage and denitrification is significant to figure out the metabolic way of eukaryote in anoxic environment and to quantify the balance of nitrogen in marine environment. The history of foraminiferal intracellular nitrate storage and denitrification study was discussed. In addition, the distribution of foraminiferal intracellular nitrate and denitrification rates in marine environment was also discussed. The latest research progresses about the related mechanism were also summarized. Finally, the problems and challenges in present and future studies were discussed.
硝酸盐是限制海洋初级生产力非常重要的营养盐之一, 并且在海洋生物地球化学循环中起到非常重要的作用[1]。在海洋氮循环过程中, 反硝化和厌氧氨氧化是实现固定态氮从海洋环境中移除的2个主要途径[2]。反硝化作用指的是在厌氧环境下, 生物利用硝酸盐作为电子受体氧化有机质的同时, 将硝酸盐经由亚硝酸盐、一氧化氮、氧化亚氮最终异化还原为氮气, 实现固定态氮移除的过程[3, 4]。反硝化作用一直以来被认为是只能发生在原核生物中的细菌和古菌体内[5, 6], 而底栖有孔虫是第一种被发现能够将硝酸盐彻底还原为氮气的真核生物, 证明了真核生物也能够将固定态氮直接从海洋环境中移除[7]。在随后的研究中, 越来越多的有孔虫属种被证实能够进行反硝化, 这在生物系统发生学上拉近了真核生物与原核生物之间的距离, 同时也扩展了我们对于海洋沉积物氮循环的认识[8~10]。通过估算, 发现有孔虫的反硝化速率对于沉积物整体反硝化的贡献率范围为4%(相模湾[11])到大于70%(比斯开湾和斯克格拉克海峡[8]), 在某些海区甚至超过了原核生物的作用[12], 因此对于定量沉积物中氮的移除不能忽视底栖有孔虫的作用。同时, 有孔虫体内储存有非常高浓度的硝酸盐, 甚至比周围环境高上万倍[7, 8, 10], 有孔虫体内储存的硝酸盐独立于间隙水中的硝酸盐是海洋沉积物中重要的硝酸盐储库。这部分硝酸盐可能储存在有孔虫体内液泡中[10], 能够在缺少硝酸盐和氧气的沉积物环境中为有孔虫提供硝酸盐从而进行无氧呼吸维持正常的生命活动。因此了解有孔虫细胞内储存硝酸盐和反硝化对于我们进一步理解海洋的氮循环也有至关重要的作用。
底栖有孔虫是沉积物中底栖生物的主要组成部分, 能够广泛分布在各种海洋环境中。其中大量有孔虫分布在低氧甚至无氧的沉积物中[13~15], 在厌氧环境中其对于有机质的降解起到非常重要的作用[16, 17]。但一直以来对于底栖有孔虫在无氧环境下生存的机理并不清楚, 直到发现有孔虫能够储存硝酸盐并进行反硝化, 才证实了底栖有孔虫是一种兼性厌氧的原生生物, 因此能够适应沉积物的极端低氧环境[18]。同时有孔虫通过移动对硝酸盐转移和反硝化, 可降低无氧环境下有机碳的埋藏效率同时增加固定态氮的移除[19]。了解有孔虫在低氧和无氧环境中生存的机理, 也对我们进一步认识真核生物在氧气缺乏环境下的生存机理有着很重要的借鉴作用。然而国内关于底栖有孔虫体内储存硝酸盐和反硝化的相关研究报道较少[20]。
本文总结了底栖有孔虫体内储存硝酸盐和反硝化的研究现状, 介绍了底栖有孔虫在沉积物氮循环中的作用, 以及目前相关的机理研究。并且探讨了有孔虫反硝化研究领域中还存在的一些问题, 希望为开展相关的研究工作提供借鉴。
海洋沉积物中的硫细菌(Thioploca)是首次被发现体内能够储存高浓度(500 mmol/L)硝酸盐的原核生物[21]。而近年来, 越来越多的海洋真核生物(鞭毛藻、硅藻、定编藻、绿藻、有孔虫等)也被报道细胞内能够储存高浓度的硝酸盐[8, 22~24]。在海洋环境中, 真核生物细胞内和细胞外的硝酸盐能够被用于进行同化作用和异化作用[12]。在同化作用过程中硝酸盐首先被还原为铵, 进一步用于合成生物体内的氨基酸和核酸等从而转化为生物量。而在异化作用过程中, 通常在无氧环境下利用硝酸盐作为电子受体氧化有机质为生物生命活动提供能量, 因此硝酸盐在生物的生命活动中起到非常重要的作用。而沉积物间隙水中的硝酸盐主要来自上覆水中硝酸盐分子扩散以及在沉积物氧化层铵的氧化, 因此硝酸盐一般只能扩散到氧气渗透深度以下几毫米到几厘米的无氧沉积物中[25], 在更深层次的沉积物中硝酸盐利用一般都受到限制。由于在无氧的沉积物环境中硝酸盐具有最高的还原电势能, 并且硝酸盐及其还原产物没有生物毒性, 这就促使底栖有孔虫在细胞内大量吸收和储存高浓度的硝酸盐, 使其不受沉积物间隙水中硝酸盐限制的影响, 并支持其在无氧以及没有硝酸盐的沉积物环境下通过呼吸细胞内储存的硝酸盐而维持其生命活动[7, 9, 19]。
2006年在一次有孔虫地质学家和微生物学家合作项目中, Risgaard-Petersen等[7]首次报道了3种底栖有孔虫属种Globobulimina turgida, Nonionella cf. stella 和Stainforthia sp.细胞内能够累积储存高浓度的硝酸盐, 并且能够在无氧的条件下呼吸硝酸盐转化为氮气。这3种有孔虫细胞内储存的硝酸盐浓度为10~180 mmol/L, 比其体外沉积物间隙水中的硝酸盐浓度高500倍以上, 据估算Globobulimina turgida体内储存的硝酸盐含量能够维持其在无氧环境下生存超过1个月的时间。2008年Hø gslund等[9]在研究智利陆架外侧溶解氧最小值海域时进一步证实了Nonionella cf. stella和Stainforthia sp.体内储存的硝酸盐浓度更高于Globobulimina turgida, 比周围环境中硝酸盐的最大浓度高上万倍。2009年Glud等[11]在日本的相模湾也发现Globobulimina affinis, Globobulimina pacifica, Uvigerina akitaensis, Bolivina spissa和Textularia sp.属种体内能够储存高浓度的硝酸盐。2010年Piñ a-Ochoa等[8]报道了大量有孔虫属种都具有体内储存高浓度硝酸盐的能力。其中测定的67种有孔虫属种中, 有超过一半的有孔虫属种体内都储存浓度超过0.1 mmol/L 的硝酸盐。此后, 越来越多的有孔虫属种(Fursenkoina cornuta, Bolivina argentea[10], Uvigerina akitaensis, Bolivina spissa[26], Ammonia tepida[27]等)接连被报道具有体内储存高浓度的硝酸盐的能力。
这些有孔虫属种分别采集自不同的海洋环境中, 包括陆架、陆坡和近岸沉积物以及氧值最小区以下的沉积物, 这说明有孔虫体内储存硝酸盐广泛出现在各种海洋环境中。通常反硝化被认为只发生在无氧的环境下, 但有孔虫体内储存硝酸盐不只是出现在无氧的栖息环境中, 有氧环境中生存的有孔虫属种(如Pyrgo elongata等)也被发现体内储存硝酸盐[8]。Koho等[28]和Piñ a-Ochoa等[29]通过培养实验的方法证明有孔虫属种Globobulimina turgida在有氧和无氧环境下都能够吸收和储存高浓度硝酸盐。此外相同的属种在不同的海洋环境中细胞储存硝酸盐的能力也有明显不同, 例如采集自法国隆河三角洲有氧环境下的Melonis barleeanus没有发现体内储存硝酸盐, 然而采集自欧洲北海无氧而含有硝酸盐沉积物环境中的Melonis barleeanus却发现体内储存高浓度的硝酸盐[8]。总的来说, 体内储存硝酸
盐的有孔虫属种大多都分布在无氧的海洋环境中, 暴露在氧气环境中可能会减少细胞内硝酸盐含量[8]。Bernhard 等[30]发现储存硝酸盐的有孔虫细胞内都有大液泡的存在, 因此推测其细胞内的液泡可能是硝酸盐储存的细胞器。另外通过15N同位素标记培养实验的方法表明Ammonia beccarii, Bolivina argentea, Buliminella tenuata, Globobulimina turgida, Fursenkoina cornuta和Nonionella stella等有孔虫属种体内的硝酸盐都是从周围环境中的硝酸盐直接吸收而来, 而不是自己体内产生的[7, 10, 28, 29, 31]。
底栖有孔虫细胞内硝酸盐库独立于间隙水中硝酸盐库, 为了解有孔虫细胞内硝酸盐库在整个沉积物硝酸盐库中的地位, 需要精确地定量有孔虫细胞内硝酸盐储量。许多方法之前被用来释放沉积物中细胞内储存的硝酸盐, 主要包括反复冷冻融化、沸水浴加热、整柱压榨以及直接高速离心等方法[7, 19, 26, 32, 33], 这些方法的目的都是为了破坏细胞结构从而有效地使细胞内储存的硝酸盐释放到间隙水中进行定量测定。但是由于沉积物中的很多生物都存在体内储存硝酸盐的现象, 为了更精确地定量有孔虫体内的硝酸盐储量, 可以根据不同有孔虫属种的生物量及各属种个体体内储存的硝酸盐含量来估算有孔虫整体储存的硝酸盐含量[34]。Glock等[34]估算对比了秘鲁氧值最小区海域表层沉积物中有孔虫体内硝酸盐含量水平分布上的差异, 其中在氧值最小区上边界到核心区的站位有孔虫体内储存的硝酸盐从47.6 μ mol/L增加到3 955.4 μ mol/L, 在氧值最小区下边界站位有孔虫体内储存的硝酸盐减小到383.1 μ mol/L, 在氧值极小区以下有氧站位进一步减小到2 μ mol/L。因此能够明显看出不同站位之间有孔虫体内储存硝酸盐含量差异很大, 而底层水溶氧的增加可能会导致有孔虫体内储存硝酸盐减少。Koho等[28]的研究结果也表明Globobulimina turgida在无氧环境下对于硝酸盐的吸收速率大于
有氧环境下。Glud等[11]在研究日本相模湾时对比了有孔虫体内储存硝酸盐含量在沉积物垂直分布上的差异, 其中在1.5 cm硝酸盐渗透深度以上的沉积物中有孔虫体内储存的硝酸盐仅占间隙水中硝酸盐的很小部分。然而在更深层次到硝酸盐渗透深度以下的沉积物中, 有孔虫体内储存的硝酸盐库为14~39 μ mol/L, 通过计算整根沉积柱中硝酸盐储量发现80%都储存在有孔虫体内, 并且底栖有孔虫能够通过迁移将大量的硝酸盐带到硝酸盐渗透深度以下沉积物层次中。表1总结对比不同海域有孔虫体内储存硝酸盐含量与间隙水中硝酸盐含量, 能够看出有孔虫体内硝酸盐储量为间隙水中硝酸盐储量的4~25倍, 因此有孔虫细胞内储存的硝酸盐在生物地球化学过程中起到非常关键的作用。这些发现也暗示着通常用于研究海洋沉积物氮循环的15N同位素配对技术, 可能出现富集15N的N和有孔虫体内储存的大量14N的N混合不均匀现象, 这会导致运用15N同位素配对技术测定的反硝化速率出现明显的低估[37]。另外在获取沉积物间隙水过程中, 一般都是通过正压、负压或者离心等物理方法来分离间隙水和沉积物, 这可能导致细胞内储存的大量硝酸盐释放, 影响我们对于沉积物间隙水中硝酸盐的测定分析[35]。
虽然之前很多报道都证明许多有孔虫属种(Globobulimina, Nonionella, Bolivina, Bulimina, Cassidulina, Uvigerina, Epistominella和Fursenkoina等)能够生活在氧气渗透深度以下甚至硝酸盐渗透深度以下的无氧沉积物中[14, 38~46], 但反硝化作用一直被认为只能通过原核生物和真菌进行, 因此当时对于底栖有孔虫在无氧环境中代谢的机理并不清楚。直到近期的研究发现才证明在低氧或者无氧环境下一些底栖有孔虫属种自身也能够进行反硝化作用[7~10]。底栖有孔虫因此被证明是一种兼性厌氧的原生动物[10], 它进行反硝化作用就是利用硝酸盐作为电子受体接受呼吸作用电子传递链中的电子, 形成氢离子浓度梯度从而合成ATP, 在无氧环境下为其生命活动提供能量。有孔虫进行反硝化作用的优势是可以将无毒性的离子储存在体内, 从而使它的生命活动不受限于间隙水中的氧气和硝酸盐的含量。这种机制也被发现于大型的硫细菌(Thioploca和Beggiatoa)[21, 47, 48], 但不同的是硫细菌将硝酸盐还原为铵, 而有孔虫将硝酸盐还原为氮气。此外也有一些有孔虫属种(Bolivina plicata, Bolivina seminuda, Valvulineria cf. laevigata和Stainforthia sp.等)体内可能缺少反硝化过程最后一步氧化亚氮还原为氮气的酶, 只能将硝酸盐还原为氧化亚氮[8]。研究有孔虫的反硝化对于我们了解真核生物在无氧环境下的代谢过程是至关重要的, 并且也开拓了我们对于海洋沉积物氮循环新的认识, 从而能够进一步更精确地定量海洋沉积物中的氮收支。
| 表1 不同海区有孔虫整体储存硝酸盐储量和间隙水中硝酸盐储量对比 Table 1 The inventories of foraminiferal intracellular nitrate and porewater nitrate in various marine sediments |
为了定量有孔虫的反硝化速率, 进一步了解有孔虫在海洋沉积物氮循环中的重要性, 测定底栖有孔虫不同属种个体的反硝化速率成为最基础的工作。目前对于有孔虫个体反硝化速率的测定方法主要有2种:一种是在厌氧环境下添加15N标记的硝酸盐培养活体有孔虫, 通过测定产生的氮气中29N2和30N2组分随时间的变化来计算有孔虫个体的反硝化速率[7, 10]; 另一种是通过乙炔抑制的方法, 由于乙炔能够抑制反硝化过程中最后一步N2O还原为N2的酶, 因此在厌氧环境乙炔抑制作用下通过N2O微电极测定N2O浓度梯度变化, 根据菲克第一扩散定律就能计算有孔虫个体的反硝化速率[7, 8]。这2种方法在测定有孔虫个体的反硝化速率方面存在一定程度的低估[9, 49], 因此所测定有孔虫个体的反硝化速率应被认为是最小值。表2总结了目前为止已经发表的几种有孔虫属种特定的反硝化速率。对比发现不同属种的有孔虫个体反硝化速率存在很大的差异, 例如Bolivina argentea个体的反硝化速率约为Uvigerina phlegeri的43倍。同属不同种的有孔虫之间的反硝化速率也存在差异, 箭头虫属不同种间反硝化速率差异很大, 这与其所处的生存环境和个体的大小都有直接的关系[8]。另外由于不同个体间的差异, 有孔虫个体反硝化速率的测定不确定性也比较大(3%~73%)。根据有孔虫个体的反硝化速率和体内储存的硝酸盐含量, 就能够估算出有孔虫体内硝酸盐的周转时间, Globobulimina turgida体内硝酸盐能够维持其进行反硝化超过1个月的时间[7], 而Nonionella cf. stella体内硝酸盐的周转时间为2.5天左右[9]。由于Bolivina argentea, Fursenkoina cornuta具有较高的反硝化速率, 其体内的硝酸盐周转周期仅为15~17 h[10]。但是都远大于有孔虫栖息的沉积物间隙水中硝酸盐的周转周期(2~4 h)[11, 35], 这也预示着生物细胞内储存的硝酸盐比间隙水中硝酸盐有更长的消耗周期。表2还总结对比了有孔虫反硝化速率和氧气呼吸速率的差异。不同有孔虫属种个体的有氧呼吸速率为反硝化速率的3~13倍, 有氧呼吸通常被认为能够产生更多的能量[8, 50]。因此反硝化被猜测作为一种辅助代谢用于有孔虫在无氧环境下移动、摄食以及细胞的维持, 而有孔虫正常的生长和繁殖可能仍然需要氧气[8, 27]。
| 表2 不同有孔虫属种个体特定的反硝化速率 Table 2 Denitrification rates of various foraminiferal individual |
通过统计原位活体有孔虫各属种的生物量, 结合已经报道的各属种特定的反硝化速率能够估算有孔虫整体的反硝化速率[8, 11, 34]。表3总结了在不同海洋环境下对有孔虫反硝化速率的估算及其在沉积物反硝化中所占的比例。不同海域之间有孔虫整体的反硝化速率存在较大的差异, 有孔虫整体反硝化速率为1~3 000 μ mol N/(m2· d)。在空间分布上, 有孔虫反硝化速率的高值一般都位于低氧海区。在美国圣巴巴海盆、法国比斯开湾、瑞典斯克格拉克峡湾和智利氧值最小值核心区等海区, 底栖有孔虫对于沉积物反硝化的贡献甚至超过原核生物(反硝化细菌等)。也有一些海区如日本相模湾、凯尔特海琼斯海岸等, 由于能够进行反硝化的有孔虫属种生物量太少, 导致其对沉积物反硝化的贡献很小。黄海2个站位沉积物中有孔虫对于反硝化的贡献为36%~61%, 有孔虫在沉积物反硝化中的作用也不能被忽视[20]。从目前的研究结果来看, 溶解氧和食物供应是决定有孔虫整体反硝化速率的关键因素。其中在秘鲁氧值最小区海域, Glock等[34]发现有孔虫整体反硝化速率随着底层水溶解氧升高迅速降低, 因此氧气是直接影响有孔虫整体反硝化速率的关键因子, 也是决定兼性厌氧的有孔虫选择有氧呼吸还是硝酸盐呼吸的代谢方式。此外叶绿素、脱镁叶绿素和有机质等食物来源会影响有孔虫的生物量[46, 51], 从而也会影响有孔虫整体的反硝化速率。低氧海区由于水体中缺氧导致有机质的矿化速率低于有氧环境, 从而使有机质更容易埋藏, 这也为底栖有孔虫提供了丰富的食物来源, 使得这些海区有孔虫生物量非常高, 其对于沉积物反硝化的贡献也比较大[10, 34]。
| 表3 不同海区有孔虫整体反硝化速率和沉积物反硝化速率对比 Table 3 Total denitrification rates and foraminiferal denitrification rates in various marine environments |
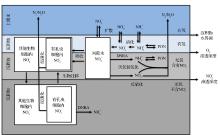
图1在不考虑生物扰动情况下的, 总结了底栖有孔虫在沉积物氮循环中所起到的作用。在硝酸盐渗透深度以上的沉积物中有孔虫能够吸收间隙水中的硝酸盐累积储存在细胞内, 很多研究也证明有孔虫体内硝酸盐储量远远大于间隙水中的储量(表1), 通过其在沉积物中的上下迁移, 它能够将大量的硝酸盐带到硝酸盐渗透深度以下的位置, 在厌氧环境下通过反硝化作用氧化沉积物中的有机质获得能量维持其正常的生命活动, 从而使得这部分硝酸盐参与到整个生物地球化学循环中[7, 9, 11, 28]。底栖有孔虫通过对硝酸盐的转运和反硝化大大降低了沉积物中有机碳的埋藏效率, 同时在反硝化过程中将硝酸盐转化为氮气, 增加了固定态氮的移除[19, 52], 因此研究有孔虫体内储存硝酸盐和反硝化, 对于更细致地了解整个海洋生物地球化学循环有很大的帮助。
在发现有孔虫能够储存硝酸盐进行反硝化之后, 对于有孔虫如何进行吸收、储存和利用硝酸盐及其对应的功能细胞器等机理并不清楚。Bernhard等[10]通过测定有孔虫体内硝酸盐同位素组成, 发现体内15N组分明显高于周围环境, 证明有孔虫反硝化过程中优先利用体内的14N, 导致15N在细胞内的富集, 同时也证明了有孔虫的反硝化作用发生在细胞内部并且利用了细胞内储存的硝酸盐, 排除了反硝化发生在细胞外的可能。由于有孔虫很早就被报道体内有内共生体的存在[13, 53~55] , 因此对于有孔虫能够进行反硝化的媒介有2种可能:一种是有孔虫自身的细胞器, 另一种是细胞内的内共生细菌。Risgaard-Petersen等[7]证明Nonionella cf. stella 和Globobulimina pseudospinescens能进行反硝化作用, 并且对其进行透视电子显微镜的观察, 没有发现其体内存在内共生细菌, 因此也就排除内共生细菌进行反硝化的可能性, 证明Nonionella cf. stella和 Globobulimina pseudospinescens可能通过自身的细胞器(如线粒体)进行反硝化。Bernhard 等[10]也报道了能进行反硝化作用的属种Bolivina argentea和Fursenkonia cornuta体内没有发现内共生体, 同时还检测到了其体内硝酸盐还原基因的存在。Bernhard 等[56]曾报道在厌氧环境下大量生存的有孔虫可能与其体内出现的大量线粒体有直接的关系。对于在厌氧环境下生存的有孔虫也曾被报道在临近外壳孔暴露的细胞处有非常高密度的线粒体存在[57]。相反在一些有氧环境下生存的有孔虫体内线粒体的密度明显偏低, 并且均匀分布在细胞内部[58]。尽管线粒体一直被认为是进行有氧呼吸的场所, 但是也有报道指出许多线粒体能够在无氧的条件下产生三磷酸腺苷(Adenosine Triphosphate, ATP)[59], 因此线粒体很有可能是有孔虫进行反硝化的媒介。之前报道Nonionella cf. stella细胞内隔离的叶绿体含有硝酸盐还原酶, 也不排除其进行反硝化的可能性[60]。此外Kuhnt等[61]和Glock 等[62]的研究结果暗示着Bolivina spissa可能通过外壳上的孔吸收硝酸盐进行反硝化, 并且通过外壳上的孔释放出反硝化过程中产生的N2O或N2。Koho等[28]证明了位于硝酸盐渗透深度以下的有孔虫只能通过上下移动迁移来吸收间隙水中的硝酸盐, 而不能通过伸出的伪足直接吸收几个毫米之上的硝酸盐。
最近, 很多研究结果表明有孔虫体内的内共生体也能参与到有孔虫反硝化过程中。Bernhard等[30]在研究胶结质有孔虫发现其体内储存高浓度的硝酸盐, 并且体内内共生有一种反硝化细菌(假单胞菌), 推测可能是有孔虫体内内共生细菌在反硝化过程中起作用。随后又报道了Buliminella tenuata细胞内有内共生细菌的存在, 并且在体内检测到硝酸盐还原基因nirK[10]。近来的发现也表明有孔虫体内储存的硝酸盐不但能够用于反硝化, 也能被内共生体用于同化作用。Nomaki等[31]通过将同位素标记的硝酸盐(富集14N或15N的N)加入到上覆水中培养沉积物中的有孔虫Ammonia sp., 发现从有孔虫细胞提取的氨基酸中氮的同位素组成与添加的硝酸盐氮同位素组成有非常好的相关性, 证明有孔虫能够吸收外界环境中的硝酸盐进入体内, 并且能够利用硝酸盐进行同化作用。此外还发现有孔虫体内氨基酸中δ 15N提高约50‰ , 通过扫描电镜观察发现有孔虫体内内共生体的存在, 因此他们推测有孔虫在利用其体内的硝酸盐进行反硝化的过程中, 优先利用14N导致15N在体内富集, 进而被体内的内共生体同化利用[26, 31, 63]。通过对比有孔虫外壳中蛋白质和细胞中蛋白质氨基酸同位素组成发现, 同化作用应该是通过体内的内共生体进行, 也提出了一种用有孔虫体内和外壳中氨基酸氮同位素的差异研究有孔虫反硝化的新方法。随后Nomaki等[26]又对采集自日本相模湾自然条件下的有孔虫样品Globobulimina affinis和Uvigerina akitaensis进行分析, 通过对比其外壳中蛋白质与细胞内蛋白质氨基酸的同位素组成的差异, 验证了这2个属种能够利用细胞内储存的硝酸盐进行反硝化作用。后续的研究工作还发现Ammonia sp.体内的电子密度在硝酸盐吸收和同化利用过程起到非常重要的作用[63]。有孔虫体内储存硝酸盐和反硝化机理的神秘面纱正在一点点被揭开, 更多的研究还需要进一步开展。
底栖有孔虫被广泛发现能够储存硝酸盐并进行反硝化, 这开拓了人们对于真核生物无氧代谢和氮循环定量的新认识, 但是对于准确定量有孔虫的反硝化速率及其吸收和利用硝酸盐的机理研究仍有较大困难, 随着技术手段的更新和研究领域的拓展将有助于更好的认识这一过程。总的来说, 目前所面临的问题和亟待开展的工作主要有以下几个方面:
(1) Piñ a-Ochoa等[8]、Bernhard等[10]、Glock等[34]和Xu等[20]的研究表明底栖有孔虫对于沉积物反硝化的贡献等同甚至超过细菌的作用[12], Glud等[11]和Larsen等[35]的研究结果却表明底栖有孔虫对于反硝化的贡献可以忽略不计(小于10%), 而很多海区相关研究工作还亟待开展, 从而更清楚地认识有孔虫对于沉积物反硝化的贡献以及重新定量评估海洋氮循环收支。目前对于有孔虫整体反硝化速率估算有很大的不确定性, 仅有11种有孔虫属种的反硝化速率被报道[7, 8, 10], 更多有孔虫属种的反硝化速率有待于进一步测定。估算时用到的有孔虫反硝化速率培养实验测定结果与原位环境下存在差异[26], 新的原位培养技术手段需要被采用从而获得更为准确的结果[12]。有些有孔虫属种(Bolivina plicata, Bolivina seminuda, Valvulineria cf. laevigata, Stainforthia sp.)的反硝化产物为氧化亚氮[8], 底栖有孔虫对于这种重要温室气体的贡献也需要进一步的定量和研究。
(2) 目前对于有孔虫进行反硝化具体的媒介还存在争议, Risgaard-Petersen等[7]和Bernhard等[10]的研究结果表明有孔虫(Globobulimina pseudospinescens, Bolivina argentea和Fursenkonia cornuta)能够通过自身细胞内的细胞器进行反硝化作用, 而Bernhard等[10, 30]也证明一种胶结质有孔虫以及Buliminella tenuata可能通过体内的内共生细菌进行反硝化作用。此外有孔虫体内储存的硝酸盐被证明不只是参与异化作用(反硝化)[31], 也能够通过体内的内共生体参与到同化过程中(将硝酸盐转化为氨基酸)[26], 而体内储存的硝酸盐在同化和异化过程中的分配情况以及内共生体与有孔虫的共生机理尚不清楚, 因此还需要更加关注有孔虫进行反硝化的细胞生理学和生物化学过程的机理研究。
(3) 目前对于确定在有孔虫反硝化过程中用于编码酶的功能基因等分子生物学的研究还远远不够[10, 18, 64], 这也限制了我们从系统发生学角度进一步认识这种厌氧代谢过程的起源和进化[12]。有孔虫是一种兼性厌氧型的生物[8, 18], 但是目前对于有氧代谢和厌氧代谢(反硝化)2种代谢途径在不同环境下的转换机制及影响因素尚不清楚。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|