作者简介:王莹(1987-),女,河南新乡人,实习研究员,主要从事微生物—矿物相互作用研究.E-mail:yingwang@soil.gd.cn
矿物与微生物相互作用是地球表层系统中重要的生物地球化学过程,是联系不同圈层物质与能量交换的重要纽带,深刻地影响着一系列重要的地表过程, 包括次生矿物的形成与演化、养分循环与污染物环境行为。在微生物—矿物的研究中,以往主要关注微生物的胞外电子传递和微生物介导的矿物溶解、沉淀、矿化等过程。由于矿物本身具有半导体性质,其在微生物胞外电子传递过程中扮演特殊的角色,这也为近期备受关注的微生物—矿物相互作用研究提供了一个崭新的视角。半导体矿物具有独特的能级结构和氧化还原性质,导致微生物—半导体矿物的相互作用机制差别很大。从热力学驱动和光能驱动2个方面分别阐述微生物—矿物间半导体导电机制的最新研究进展,并深入揭示其界面电子转移的机理。最后展望了微生物—半导体矿物相互作用的未来发展趋势。
First author:Wang Ying(1987-), female, Xinxiang City, He’nan Province, Researching trainee. Research areas include microbe-mineral interaction.E-mail:yingwang@soil.gd.cn
Corresponding author:Liu Tongxu(1980-), male, Qingdao City, Shandong Province, Professor. Research areas include microbe-mineral interaction.E-mail:txliu@soil.gd.cn
The interaction between minerals and microbes is an important biogeochemical process in the earth surface system, which links the transformation of substances and energy exchange in different earth spheres, and also affects a series of important earth surface processes, including the formation and evolution of secondary minerals, nutrient cycling and environmental behaviors of pollutants. The previous studies on microbe-mineral interaction focused on the extracellular electron transfer, and the microbe-mediated dissolution, precipitation, mineralization of minerals. Because of semiconductor properties of the mineral, it plays a special role in the process of microbial extracellular electron transfer, which can also help to understand the mutual interaction between microbe and mineral from a new angle of view. The unique energy level structures and redox properties of semiconducting mineral lead to a great difference in the mechanism of microbe and mineral interaction. The latest research progresses in the mechanism of microbe-mineral interaction mediated by semiconducting mineral were reviewed from two aspects: driven by thermodynamics and light energy. Finally, the future development trends of the interaction between microbes and semiconductor minerals were prospected.
微生物是驱动元素生物地球化学循环的引擎, 而广泛存在的微生物与矿物界面通过生物和化学作用驱动了多个重要的生物地球化学过程, 包括:岩石风化和土壤形成, 污染物的迁移转化和归趋, 碳、氮、铁、锰等元素的循环, 重金属及放射性废物的固定与活化等[1~6]。早期研究以环境行为为主, 自从Lovley等[7]与Myers等[8]发现微生物胞外呼吸这一新型能量代谢方式后, 便开启了地球表层系统过程研究的新篇章。以微生物— 矿物之间电子转移过程为核心的生物地球化学过程逐渐受到重视。
近期微生物— 矿物相互作用的研究重点, 在微生物方面, 主要研究微生物的胞外电子传递(Extracellular Electron Transfer, EET)过程, 包括外膜蛋白直接传递、电子穿梭体介导的间接传递以及纳米导线等机制[9~12]; 在矿物方面, 主要关注微生物介导的矿物溶解、沉淀、矿化等过程[13, 14]。近期研究提出了矿物可以与铁还原菌建立导电网络, 利用半导体作用介导胞外电子传递过程[15, 16]。我们近期研究也发现, 铁矿物(如针铁矿α -FeOOH、纤铁矿γ -FeOOH、赤铁矿α -Fe2O3和磁铁矿γ -Fe2O3)及非铁矿物(如TiO2)可以明显加速铁还原菌对于硝态氮的还原和生物产电的效果, 并提出了半导体矿物导带介导电子传递的机制[17, 18]。外膜蛋白与氧化铁矿物间的直接电子传递过程被广泛认为是异化铁还原的基本过程[13]。前期研究显示, 外膜蛋白中起主要作用的血红素蛋白其还原态电子可以注入半导体矿物的导带位置, 从而导致电子受体(如卤化物、电极等)可以快速捕获该电子[19, 20]。因此, 微生物外膜蛋白与半导体矿物导带进行电子传递可能是一种重要的微生物胞外电子传递方式。
地球上的矿物种类繁多, 除了大量存在的硅酸盐矿物, 还包括诸如氧化物、硫化物等具有半导体性质的矿物[21]。从能带理论来讲, 半导体矿物由能级较低的价带和能级较高的导带组成。在能量高于其禁带宽度的光照下, 矿物半导体价带电子可以被激发并跃迁至导带, 产生具有还原性的高能导带电子, 同时在价带留下具有氧化性的高能空穴。在热力学方面, 从矿物半导体的供给和接受电子能力来说, 氧化物半导体的导带空轨道较容易接受电子, 而硫化物半导体价带电子的供给能力较强。如果矿物半导体表面吸附具有较高能量的离子, 即表面离子电位负于半导体导带位置, 即使没有光激发的情况下, 其电子也可以自发转移到半导体矿物的导带上, 将电子进一步传递给矿物半导体表面吸附的氧化还原电位较低的物质[21], 或者直接导致矿物表面的溶解与矿物转化[22, 23]。这种情况可能是深层土壤或沉积物中微生物与矿物间电子传递的主要途径。
光是影响矿物半导体性能的重要因素[24], 是地球上的能源来源与万物生长的必要条件, 其在半导体矿物— 微生物的相互作用中也起到举足轻重的作用。光照可以激发半导体产生光生导带电子和价带空穴。光照半导体与微生物之间的相互作用研究以往主要针对紫外线防护[25, 26]、光催化杀菌[27~29]等, 而近期研究显示, 光激发半导体矿物产生电子可促进微生物生长或产电[30~33]。
目前关于半导体矿物与微生物相互作用的机制研究较少, 相关生物地球化学过程及环境效应仍有待深入解析。从宏观过程方面来看, 鲁安怀等[34~36]和Dong等[37]最近提出微生物与矿物之间除了微生物形成、分解和转化矿物的作用外还有协同作用, 即在光照的情况下, 矿物的存在促进了非光合微生物的生长, 而微生物的存在也进一步促进了矿物的形成、分解及转化。本文从微观电子传递机制方面, 综述了半导体矿物与微生物电子传递的相关研究, 并根据微生物与矿物间电子传递过程中驱动力不同分为热力学驱动机制和光能驱动机制。
不同物质之间存在热力学性质差异, 其氧化还原电势的差异可反映其电子传递的驱动力, 如公式(1)所示, 电子受体与电子供体之间的差值即电子传递的驱动力。在微生物— 半导体矿物体系中, 由于微生物外膜蛋白和半导体矿物导带的氧化还原电势都具有很宽的范围, 所以根据导带电位(E导带)与外膜蛋白电位(E外膜蛋白)的电势差(公式(2)和(3)), 可以实现导带与外膜蛋白之间的电子传递过程。
Δ E=E电子受体-E电子供体 (1)
Δ E微生物→ 矿物=E导带-E外膜蛋白 (2)
Δ E矿物→ 微生物=E外膜蛋白-E导带 (3)
在深层土壤或沉积物中, 许多细菌和古菌都能够还原金属氧化物, 其中研究最多的是异化金属还原菌(Dissimilatory Metal Reducing Bacteria, DMRB)中Geobacter菌属和Shewanella菌属。DMRB利用金属氧化物作为胞外电子受体进行呼吸作用, 这种胞外电子传递过程可直接影响碳氮等元素循环、矿物转化、污染物降解, 并应用于微生物产电等过程[38~41]。DMRB与矿物间的电子传递主要通过3种方式:外膜蛋白直接传递、电子穿梭体介导的间接传递以及纳米导线等机制[42, 43]。然而, 这些机制主要关注电子从微生物传导至矿物的过程, 电子在矿物结构中如何传递并不清楚, 而该过程很可能是微生物— 矿物体系的环境效应的重要控制因素。
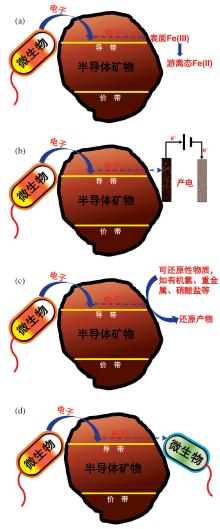
微生物— 半导体矿物的电子传递结果主要分为2种:一种是矿物作为微生物的终端电子供体或受体导致矿物的分解, 并通过金属离子的氧化还原循环完成长距离的电子传递。如含高价金属元素Fe(III)和Mn(IV)等矿物半导体中的空轨道组成的导带作为胞外电子受体破坏矿物表面的化学键导致矿物溶解。另一种是矿物在微生物与终端电子受体之间起到介导电子传递作用, 包括3种情况:①半导体矿物介导微生物的胞外电子传递至电极的过程(产电); ②半导体矿物介导微生物胞外电子传递至电子受体(如有机氯、重金属、硝酸盐、硫酸盐、腐殖质等); ③在互营的微生物共存时, 供养微生物通过半导体矿物的介导作用将胞外电子传递给寄养微生物。图1介绍了上述4种矿物导带介导的电子传递过程。
金属氧化物作为厌氧微生物呼吸作用的终端电子受体研究众多, 最为典型的是DMRB以Fe(III)或Mn(VI)矿物作为终端电子受体将其转化为溶解态Fe(II) 或Mn(III)[13]。以往研究主要认为DMRB通过胞外电子传递过程可以将电子直接传递至矿物表面, 从而导致表面的金属离子还原为低价离子, 然后与表面存在的氧化性物质或合适微生物相互作用, 这个过程可以称之为通过矿物溶解的变价离子导电, 如赤铁矿通过Fe(III)/ Fe(II) 循环介导电子传递[44]。然而针对矿物的半导体性质, 有关亚铁离子与铁矿物相互作用的研究显示, 在不同晶面的电位梯度驱动下, 吸附态亚铁可以将电子传递到不同的氧化铁矿物晶格, 导致氧化铁矿物不同表面位置的铁原子溶解[45]。并且, Yanina等[46]提出结晶较好的矿物半导体(如赤铁矿)具有导电作用可以将体相表面的吸附或溶解的Fe2+的电子通过晶体块体传递到另一表面处。Boland等[47]也采用半导体机制量化分析亚铁催化水铁矿晶型转化的反应。因此, 微生物也有可能在和与其能级匹配的半导体矿物相互接触时, 将胞外电子传递至半导体矿物的导带能级, 在将变价金属离子的高价还原低价过程中也会伴随电子在晶体内的导电过程, 从而完成长距离的电子传递。
近十几年来, 微生物的产电功能已经广泛报道, 前期研究的关注点主要是高效能产电微生物、构型改进以及电极改性等[48~50]。近期研究发现, 电极表面负载矿物对于微生物的电极呼吸性能有显著影响[51~53]。Nakamura等[16]研究了4种氧化铁(赤铁矿、针铁矿、磁赤铁矿和磁铁矿)对Shewanella loihica PV-4的胞外电子传递机理的影响, 发现赤铁矿和针铁矿胶体存在时菌的呼吸电流明显增强了约40倍, 磁赤铁矿和磁铁矿存在时电流也增强了约4倍。该研究通过光照射半导体— 菌复合电极产生的光电流测试, 发现针铁矿和赤铁矿的加入会产生有较大的光电流, 而磁赤铁矿和磁铁矿的存在却没有显著光电流产生。根据赤铁矿、针铁矿、磁赤铁矿的光电流测试估算其导带电位分别为-0.01、-0.02和+0.15 V(vs. SHE); 通过测试磁铁矿伏安扫描可估算其费米能级约为+0.48 V, 表明了赤铁矿、针铁矿与OM c-Cyts(Em:0.02~0.05 V)电位很接近。因此, 在热力学上赤铁矿、针铁矿导带电子较易传递给OM c-Cyts, 加速了微生物的新陈代谢从而增强微生物的胞外电流产生; 而磁赤铁矿和磁铁矿的EC却与OM c-Cyts的Em相差0.1 V以上, 不易与OM c-Cyts发生电子传递, 因此对胞外电子传递的影响较小。我们前期的研究也发现上述4种氧化铁增强了2种芽孢杆菌发酵菌Bacillus sp.和Klebsiella pneumoniae L17的微生物电流产生[17, 18]。
Kato等[54]研究了氧化铁对Geobacter菌属的胞外电子传递能力的影响, 通过研究5种Geobacter菌分别在无铁矿物, 有赤铁矿、磁铁矿和溶解铁(柠檬酸铁)的条件下微生物产电能力, 发现在有氧化铁存在时, G. sulfurreducens, G. bremensis和G. pelophilus产生的电流很接近, 但是在无氧化铁时, G. sulfurreducens的电流显著高于其他微生物, 通过扫描电镜及电化学测试, 发现G. sulfurreducens在无氧化铁时生成了导电生物膜, 而有氧化铁时细菌优先产生了细菌— 矿物导电网络而没有形成生物膜。由于导电生物膜的电子传递效率远高于导电网络, 所以氧化铁的存在降低了G. sulfurreducens的呼吸电流。这对广泛存在氧化铁矿物的土壤环境中的微生物— 矿物相互作用具有重要意义。
上述纯菌体系研究证明异化铁还原菌能够利用氧化铁作为电子导体将电子远距离传输给终端电子接受体, 除此以外, Kato等[55]还研究了氧化铁半导体矿物对土壤环境中微生物的呼吸作用的影响, 发现赤铁矿、磁铁矿或者水铁矿的添加都能够引起电流的增加近30倍, 而可溶性的Fe(III)/ Fe(II)溶液的加入只能增强10倍左右, 其中作为绝缘体的水铁矿也能够增强微生物呼吸电流是因为水铁矿在呼吸过程中转化为半导体针铁矿, 从而促进电子传递能力。
土壤中硫铁矿也广泛存在, 微生物也可以通过与硫铁矿的相互作用中获得能量完成新陈代谢。Nakamura等[56]和Jiang等[57]利用S. loihica PV-4生物合成四方硫铁矿FeS都增强了PV-4的胞外呼吸电流。FeS的结构是由Fe和S原子组成的四面体层间的范德华引力组成, 存在离域的3d电子[56]。因此, 在厌氧条件下, 生物合成的FeS具有导电性从而增强Shewanella oneidensis MR-1的呼吸电流[58]。通常MR-1菌的胞外电子传递是通过广泛认可的Mtr(metal reducing)方式进行的; 而有FeS时, Mtr的传递方式并不是最主要的胞外电子传递方式, FeS的半导体介导电子传递机制可能在此过程中起到了重要作用[59]。
微生物— 矿物相互作用对污染物的迁移转化、元素循环和重金属的固定与活化等过程具有重要影响[1~6]。前期研究主要关注微生物作用下铁、锰等变价金属氧化还原循环导致的污染物转化与元素循环[60], 而矿物作为半导体的角色一直没有引起重视。从热力学上, 如果半导体矿物的导带能级接收微生物的胞外电子, 可传递给氧化还原电位较正的底物, 如硝酸盐、硫酸盐、腐殖质及重金属和有机物等可还原性污染物[40, 61~63], 从而导致其还原转化。以往认为, 氧化铁矿物与这些底物同为竞争性电子受体, 在微生物作用下会互相抑制[64, 65]。本研究组近期通过研究铁还原菌— 氧化铁— 硝酸盐体系, 发现4种氧化铁可显著增强2种发酵型细菌的硝酸盐还原速率, 并提出了铁氧化物半导体导带介导了铁还原菌与硝酸盐的电子传递机制[17, 18]。进一步采用非铁氧化物证实了矿物导带传导电子的机制:铁还原菌的胞外电子通过外膜蛋白快速传递到氧化铁导带, 进而传递给电位较正的硝酸盐, 加速了硝酸盐的还原转化。
在生物圈中, 微生物分泌的代谢物也可以被其他微生物所利用, 寄养微生物对代谢物的消耗会加速供养微生物的代谢以产生更多的代谢物, 此为互养共生。产甲烷菌群落是较为典型的互养共生的例子, 其电子主要来源于还原性物质如氢或甲酸盐[66, 67], 最近发现微生物也可以通过生物(如鞭毛)和非生物(如导电矿物)进行种间电子传递。
Kato等[68]首次报道了导电矿物可以通过电流方式实现种间电子传递。在2种细菌的共同培养体系中, Geobacter sulfurreducens可利用乙酸作为电子供体, Thiobacillus denitrificans可利用硝酸盐作为电子受体。采用单一菌时, 既无乙酸氧化也无硝酸盐的还原; 加入赤铁矿和磁铁矿时, 乙酸和硝酸盐都降低, 同时N
最近有研究发现, 磁铁矿也可替代鞭毛中的c-Cyts进行种间电子传递[72]。磁铁矿能够在敲除OmcS蛋白的Geobacter中介导胞外电子传递过程, 即磁铁矿可以通过类似于c-Cyts的方式促进胞外电子传递。近期另外一项研究也阐释了类似的机制, 中性红染料可以形成具有半导体性质的晶体, 充当电子传递蛋白的角色, 促进种间电子传递, 进而促进甲烷产生[73]。
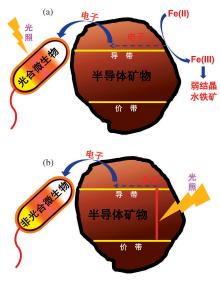
地球表层存在大量光合微生物如紫色细菌、蓝细菌和绿硫细菌等[48], 利用太阳光获得能量, 并与环境中物质相互作用。由于半导体具有独特的光化学性质, 矿物的半导体性质也逐渐受到重视[21]。太阳光作为地球上万物生命活动能量的来源, 成为了地表微生物— 矿物相互作用的重要因素。半导体矿物吸收太阳光产生光生电子, 可以被地表的非光合微生物利用完成自身新陈代谢。我们分别从微生物获取光源和矿物获取光源2个方面来阐述(图2):①光能驱动光合微生物— 矿物电子传递; ②光能驱动非光合微生物— 矿物间电子传递。
目前关于地表半导体矿物与光合微生物的相互作用的研究极少。在厌氧条件下, 光合亚铁氧化菌Rhodopseudomonas palustris TIE-1 和 Rhodobacter ferrooxidans SW2可以氧化溶解态亚铁离子生成三价铁, 进而形成纳米尺寸的水铁矿, 而铁矿物对紫外光的吸收特性可使微生物细胞免于被紫外线破坏, 这对早期地球的还原性环境中, 生命的起源起到保护和促进作用[25]。最近报道发现R. palustris TIE-1在有光或无光条件下都可以通过PioABC(Pio-phototrophic iron oxidation ABC)外膜蛋白接受固体矿物电极上的胞外电子。其机制为:TIE-1将溶解态Fe(II)氧化为三价铁获得电子和能量实现自身生长, 而三价铁则形成结晶度较低的水铁矿, 进一步转化为结晶度较高的针铁矿和磁铁矿, 从而介导电子传递或Fe原子交换, 实现Fe(II)与光合铁氧化菌的长距离电子传递[74]。另外, 在光照条件下, 因为光合微生物TIE-1可以通过卡尔文循环实现固碳, 所以一部分来自矿物的电子可能会进入生物质中, 从而导致生物量增加实现光合微生物的增殖。但是该电子传递机理尚未得到证实, 且并未涉及矿物的半导体性质。半导体矿物吸收光能后所产生的电子跃迁作用, 是否影响矿物表面性质、微生物生长代谢及胞外电子传递过程, 尚未得到关注。
光合微生物中蛋白(PSI/PSII:photosystem I/ photosystem II)与半导体矿物复合的研究很多。主要是人工合成系统在光能转换成氢能或电能、或生物传感器等的应用。通过半导体的复合可以有效分离光合系统PSI/PSII产生的高能电荷, 从而增强分解水的效率[75, 76], 也可以应用在生物光伏电池上, 提高光电效率等[77~79]。但是活体光合微生物与半导体矿物界面电子传递方面的研究很少, Ochiai等[80, 81]早期曾使用活体蓝藻固定在SnO2导电电极上作为工作电极在光照下产生光电流并进一步对产生氢气的研究, 而后续研究并未涉及活体光合微生物的半导体电子传导机制。
半导体矿物吸收光子产生的光生电子可以作为非光合微生物的电子供体, 因此, 非光合微生物除了通过氧化环境中还原性物质得到电子, 也可以利用非还原性矿物(如TiO2, Fe2O3)等吸收光能所产生的光生电子, 通过矿物导带传至微生物的外膜蛋白, 进行电子传递, 从而促进微生物的代谢与生长。
在地球早期的还原性环境中, 一些广泛存在的由于地质作用所形成的含硫铁矿物能够吸收紫外线保护细菌免于紫外线辐射, 使它们存活在古代海洋的浅光区[25]。而铁矿物吸收紫外线所产生的高能电子可能会进一步被非光合微生物利用进行新陈代谢而生长。Lu等[30]和Li等[31]报道, 非光合微生物(化能自养型的嗜酸亚铁氧化菌)可以通过外电路间接利用矿物半导体(如金红石TiO2、闪锌矿ZnS和针铁矿)吸收太阳光产生的电子完成代谢过程。矿物的光生电子通过外电路转移到Fe(III)使其还原, 为非光合微生物提供了源源不断的Fe(II)促进其生长。Lu等[30, 82]还发现了异养型微生物Alcaligenes faecalis和土壤的微生物群落同样能够利用半导体的光生电子促进自身生长。
最近研究还发现, 一些细菌会通过利用太阳能合成金属硫化物, 同时完成CO2的固定来获得能量、材料或食物等。Sakimoto等[83]利用非光合CO2还原菌Moorella thermoacetica生物合成的纳米CdS在光照下促进CO2的固定还原为乙酸, 乙酸又可以为菌提供食物以促进其生长。具体的机理如下:微生物可以将体系中的半胱氨酸的巯基还原为S2-, 与体系中的Cd2+产生附着在细菌表面的CdS固体; 由于半导体CdS的较窄禁带宽度, 吸收可见光产生的光生电子与表面的H+结合产生固定CO2所需要的重要活性中间体H质子; 而光生空穴被表面的半胱氨酸所猝灭产生二硫键氧化态。与自然光合系统相比, 该体系有着较高的量子效率、较少的能量损失等; 并且在光合固定CO2的同时半导体产生的氧化性物质可能会进一步发展成产氧、污水氧化处理或生物质的氧化转换等有益的反应。半导体纳米颗粒的聚集耦合微生物的新陈代谢过程也为研究微生物— 矿物的电子转移提供了进一步依据。
此外, Nakamura等[15]提出微生物与矿物界面形成导电网络, 半导体的光生电子可以直接传递给微生物外膜蛋白c-Cyts。由于外膜蛋白c-Cyts的电位与赤铁矿导带位置接近不存在能量障碍, 光生电子可以从导带上转移到外膜蛋白c-Cyts上, 再从外膜蛋白c-Cyts传递到另一赤铁矿导带上, 这样互相交替传递最终到达电极上产生光电流。利用提纯的生物外膜蛋白直接与矿物电极作用的体系研究也可以进一步理解微生物与矿物的电子传递机理[84]。Dias 等[85]研究了锐钛矿TiO2被光激发产生的导带电子可以转移到氧化态的c-Cyts上将其还原。该过程类似于生物光合系统的电子转移过程。同样用模拟太阳光照射赤铁矿亦可以将c-Cyts还原[86]。以上研究均证实了光能驱动微生物— 矿物间的电子传递过程的重要性。
微生物与矿物间的相互作用, 是当今地球科学的核心科学问题。微生物— 矿物间的分子反应过程是破解元素循环的重要途径, 具有重要的科学价值。从矿物半导体性质这一角度研究微生物与矿物间的相互作用, 可以为其分子机制的研究提供崭新的视角, 并可促进材料物理化学、微生物学与地球科学的交叉融合。尽管目前微生物— 半导体矿物的电子传递机制研究已经取得了一定的进展, 仍有很多科学问题亟待解决。
(1) 微生物— 半导体矿物相互作用过程中, 半导体机制、微生物机制、矿物表面化学机制等同时发生, 又互相耦合, 因此如何解析各反应机制?如何定量评估各机制的相对贡献?解决这些问题, 可以总体评价半导体机制在自然界中的重要性。单纯靠表征手段及动力学实验往往难以区分不同反应机制, 通过建立反应动力学的数学模型, 可能是获得各机制速率常数、评估各机制相对贡献的有效手段。
(2) 目前微生物— 矿物间电子传递的半导体机制的研究在热力学驱动的电子传递机制方面主要集中在氧化铁矿物, 而其他种类的半导体如部分硫化物、金红石、闪锌矿、氧化铜等在合适的电位范围内是否也可与微生物发生热力学驱动的电子传递?半导体矿物的结构与性质对其有何影响等问题仍缺乏研究。
(3) 微生物与矿物半导体界面相互作用的机制不同。较多研究的是金属还原菌和亚铁氧化菌及部分产甲烷菌, 而其他种类的微生物与矿物作用时是否也存在半导体矿物介导的电子传递机制?具体的作用方式是什么?微生物外膜蛋白的结构与性质在电子传递过程中作用?
(4) 光能驱动下, 非光合微生物可以利用半导体的光生电子促进自身生长。在早期地球无氧状态下, 此机制在二氧化碳还原为有机碳过程中发挥着怎样的作用?此构想如果成立或许对早期地球还原性环境中生命的起源有重要启示作用。
(5) 在光照下, 有机分子如腐殖质、金属络合物等可以光敏化半导体实现电子穿梭过程, 因此, 自然界中具有电子穿梭功能的有机质对半导体矿物— 微生物间的电子传递有何种影响仍有待研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
|
| [86] |
|