作者简介:王九一(1983-),男,河南南阳人,助理研究员,主要从事蒸发盐沉积与古气候研究.E-mail:wjyhlx@163.com
蒸发盐矿物流体包裹体能够将结晶卤水中的嗜盐菌包裹起来,并随着盐类沉积而将其封闭保存起来。在矿物流体包裹体的缺氧、密闭、低营养的极端环境中,一些古代的嗜盐菌经历数万年,甚至数百万年仍然保持活性。对石盐流体包裹体中古嗜盐菌的发现、分离和鉴定历史进行详细综述,系统论述古嗜盐菌引发的地质学家和微生物学家的长期论战,提出该领域存在的问题,并展望未来的研究方向。蒸发盐矿物流体包裹体古嗜盐菌的研究需要重视蒸发盐岩的岩相学和沉积环境分析,并遵循严格的微生物学实验策略。古嗜盐菌的未来研究应重点关注石膏、钙芒硝、天然碱等蒸发盐矿物,着眼于识别和鉴定更古老的古嗜盐菌,探究古嗜盐菌的生存机制。
First author:Wang Jiuyi(1983-), male, Nanyang City, He’nan Province, Assistant professor. Research areas include evaporites and paleoclimate.E-mail:wjyhlx@163.com
Fluid inclusions trapped in ancient evaporites can contain a community of halophilic prokaryotes and eukaryotes that inhabited the surface brines from which the minerals formed. Entombed in the fluid inclusions in evaporites, some of these halophilic microbes remain viable for at least tens of thousands of years and possibly for hundreds of millions of years, even under high salinity, low oxygen, high radiation, low nutrient concentration. This review presents the scientific history of discovery, isolation, and culture of ancient halophilic microbes in halite fluid inclusions. We elucidated the controversy associated with the ancient halophilic microbes between geologists and geomicrobiologists. Major concerns and future perspectives on halophiles research were proposed. We emphasized that lithofacies analysis and depositional environment determination on evaporites are prerequisites before any microbiological survey, and rigorous biological protocol must be obeyed at all retrieval procedures for ancient microorganisms. We suggested that future study related to ancient halophilic microbes should focus on other evaporites such as gypsum, glauberite, and trona, characterize and identify older halophiles; clarify metabolic mechanism for longevity of ancient microorganisms.
高盐度盐湖不断析出各种盐类矿物, 如石盐、石膏、芒硝、天然碱、苏打石等。这些矿物晶体在结晶过程中, 将结晶母液有规律地沿晶面包裹起来, 形成蒸发盐矿物流体包裹体[1, 2]。如果这些包裹体的体积较大, 生活在结晶母液中的一些盐湖嗜盐菌就容易被包裹起来, 进而随着矿物的沉积、压实、固结成岩而被保存下来。因此, 包裹在古代蒸发盐矿物流体包裹体中的嗜盐微生物被称为古嗜盐菌。
由于对石盐的结晶机理、流体包裹体形态、沉积环境及其保存条件的研究较为充分, 过去数十年, 地质学家和微生物学家对石盐流体包裹体开展了大量的古嗜盐菌研究。石盐流体包裹体中的古嗜盐菌最早发现于20世纪60年代, 随着探索地外生命的热潮自20世纪90年代以来得到很大关注, 包括鉴定、提取和培养包裹体中古菌和细菌[3~14]、原核生物的DNA测序[15~19]、鉴定包裹体中的有机质成分[2, 20~22]等。现已查明, 古代原生石盐晶体的流体包裹体内存在由嗜盐原核生物、真核生物和其他有机质组成的微型“ 生态系统” [9~13, 19, 20]。原生石盐晶体均从古代盐湖原生卤水中析出, 代表原始盐湖微生物生态系统的状况。众多研究发现, 流体包裹体内保留了大量的DNA物质甚至仍然存活的细菌和古菌细胞[3, 6, 7, 9~13, 18, 23]。微生物培养实验证明, 在美国死谷盆地年龄为34 ka的石盐流体包裹体中发现的古嗜盐菌仍然具有活性[11]。对从该流体包裹体中分离的菌株进行的16S rDNA测序分析表明, 该菌株进化谱系与Mormile等[7]从同一层位石盐分离的菌株是一致的[18]。这些证据表明嗜盐原核生物能够长期生存或保存在石盐流体包裹体内。Schubert等[10]和Lowenstein等[20]提出, 在流体包裹体内, 与原核生物一起被捕获的盐湖杜氏藻所提供的甘油等有机大分子很可能是嗜盐原核生物能够生存数万至数百万年的能量来源。这样看来, 在盐湖环境中, 嗜盐微生物繁盛、盐类矿物结晶与流体包裹体形成的耦合机制使得蒸发盐矿物流体包裹体成为古嗜盐微生物存活下来的唯一可能场所。然而, 目前国内科研界在此领域的研究基本处于空白状态。最近, 作者对柴达木盆地第四系原生石盐开展了详细的古嗜盐微生物学研究, 在显微镜下发现了2.26~0.13 Ma的古嗜盐菌, 并指出古嗜盐菌的繁盛、衰亡与古水活度和亚洲内陆干旱化进程密切相关[14]。为更好地呈现当前国际学界对石盐流体包裹体开展的古嗜盐菌前沿研究成果, 本文对石盐流体包裹体中古嗜盐菌的发现、识别和鉴定历史, 及其引发的地质学和微生物学界的长期论战进行详细综述, 并对该领域的未来研究提出展望和建议, 以期对国内地质微生物学界在古嗜盐菌领域的研究有所裨益。
石盐流体包裹体通常呈立方体状、矩形棱镜状或不规则的多种形态, 一般为微米级, 偶尔可达数毫米。流体包裹体中还常见气体、矿物和微生物等[1, 2]。石盐流体包裹体的大小、形态、数量和排列方式取决于晶体形成时的沉积环境和生长速率[24, 25]。原生石盐晶体内的原生流体包裹体一旦形成并随着石盐沉积埋藏后, 就不再受到紫外线辐射的影响; 并且, 其包裹的卤水是高盐度的饱和NaCl溶液, 为氧气含量极低的缺氧环境, 有利于微生物细胞及其生命物质的保存。因此, 原生石盐流体包裹体是研究古嗜盐微生物的理想载体。
20世纪60年代, Dombrowski[26]最早从德国巴德诺海姆二叠纪蔡希斯坦盆地的热盐泉和盐矿中分离出嗜盐菌Pseudomonas halocrenae。Reiser等[27]发现, 美国堪萨斯州二叠纪的石盐流体包裹体中赋存大量静态的双球菌状微生物, 他们认为这些微生物是已经死亡的二叠纪古细菌。随后, Dombrowski[28]对欧洲二叠纪和世界各地的更古老盐岩开展了相似的研究, 在石盐晶体基质中发现了杆状细菌。通过形态学和分类学对比分析, 他判定这种杆状细菌为环状芽孢杆菌(Bacillus circulans)。此后, 他对二叠纪蔡希斯坦盆地、世界其他地区的中泥盆纪、志留纪和前寒武纪的盐岩进行进一步的研究[29], 从石盐晶体基质中分离出二叠纪的古细菌, 但未能提供细菌的显微照片。他认为缩水机制和高盐化环境使得这些细菌能够在石盐中保存长达数百万年。在严苛的表面消毒和对照试验控制下, Bibo等[30]重复了Dombrowski的试验, 发现从原生石盐中不仅能够分离出这些微生物, 而且可以对其进行培养。Norton等[31]在实验室内模拟石盐流体包裹体内的嗜盐菌捕获机制。他们将先前报道的嗜盐菌加入饱和NaCl溶液中, 发现被捕获在流体包裹体中的嗜盐菌能够保持6个月的活性, 其中一些在3周后仍然可以运动。Norton等[32]从英国温斯福德盐矿的三叠纪盐岩中分离出7种古菌株, 鉴定结果表明它们属于Halorubrum和Haloarcula属。Grant等[33]在20 Ma的石盐晶体原生流体包裹体中观察到具有荧光效应的有机物, 认为它们属于古嗜盐菌的残骸。Vreeland等[34]在新鲜的石盐晶体解离面观察到杆状的细菌, 判定石盐晶体是研究古嗜盐微生物的理想载体。
上述研究只是在显微镜下观察到流体包裹体中存在嗜盐微生物, 然后对整块盐岩进行微生物学分析。然而这种实验方法存在很大的问题。首先, 整块盐岩包含很多石盐晶体, 晶体间的缝隙、晶体基质都可能含有微生物, 因此, 分离的微生物并不一定来自观察到的流体包裹体; 其次, 这些微生物既可能来自于盐岩中的原生包裹体, 也可能来自次生包裹体, 如果来自次生包裹体, 那么分离出的微生物可能非常年轻, 代表的是次生改造时期的微生物状况, 而非原生石盐沉积时的盐湖水体生态状况。
如果在显微镜的控制下, 利用一种安装在微钻头上极细的针刺破石盐基质, 直接从原生流体包裹体内吸取原生卤水, 则很大程度上可以避免上述问题。Fredrickson等[35]首次应用这种方法, 对美国死谷Badwater干盐滩的DV 93-1孔石盐开展微生物学分析, 他们首次采用引物和聚合酶链式反应(Polymease Chain Reaction, PCR)技术对从包裹体中分离的有机物进行扩增, 证实原生石盐的原生流体包裹体中确实存在嗜盐菌。2000年, Vreeland等[6]设计了一种新的微型钻具, 从美国2.5亿年的二叠纪萨拉多组石盐中直接抽吸包裹体卤水(图1), 进行PCR扩增和细菌培养, 成功获取一种芽孢杆菌的菌株Bacillus strain 2-9-3。
随着古嗜盐菌DNA提取纯化、PCR扩增、DNA测序等技术的逐步完善, 古嗜盐菌的研究进入分子生物学领域。由于利用微钻吸取流体包裹体卤水需要的目标包裹体尺寸比较大, 一般要超过100 μ m[6], 而显微镜下观察到的嗜盐微生物大多保存在几微米至数十微米的包裹体中。因此, 微钻技术的应用具有很大的局限性。目前, 通用的实验流程是在显微镜下挑选出流体包裹体内含有嗜盐微生物的原生石盐晶体, 对其进行严格的表面消毒以降低现生微生物污染的可能性, 然后将晶体溶解在无菌超纯水中, 通过浓缩提取有机质的DNA, 加入嗜盐菌特异性引物, 进行PCR扩增, 对得到的PCR产物进行DNA测序, 最终鉴定嗜盐微生物的属种。
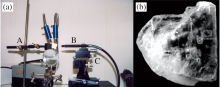 | 图1 Vreeland的实验设备(a)和美国堪萨斯州二叠纪WIPP矿洞石盐(b)[6]Fig.1 Apparatus for drilling salt crystal (a) and halite crystals taken from the Permian Salado Formation (b), Kansas[6] |
Fish等[16]对年龄分布在11~425 Ma的原生石盐晶体开展包裹体成分测试和微生物分析。DNA提取、扩增和测序结果表明, 这些包裹体中均含有古嗜盐菌。Mormile等[7]在Fredrickson等[35]的研究基础上, 继续对死谷盆地的DV 93-1孔石盐开展PCR扩增和DNA测序工作。她们从U-Th年龄为97 ka的原生石盐流体包裹体内分离并鉴定出Halobacterium salinarum。为了验证分离出的古嗜盐菌是来自石盐晶体基质还是流体包裹体, Fendrihan等[36, 37]和Adamski等[38]在实验室内模拟含嗜盐微生物的盐湖环境。他们在饱和NaCl溶液中加入Pseudomonas aeruginosa和Halobacterium salinarum这2种常见的嗜盐菌, 进行蒸发实验, 发现在自然蒸发析出的石盐晶体中, 嗜盐菌都被包裹进流体包裹体内, 而非晶体基质中, 从而证明了从原生石盐晶体分离和培养的嗜盐微生物确实来自流体包裹体内的原生卤水, 代表石盐形成时的古盐湖生态系统。
Schubert等[9~12]对美国死谷盆地的DV 93-1孔石盐开展详细研究, 从原生石盐流体包裹体内不仅发现并分离出5种分别从属于Halorubrum, Natronomonas和Haloterrigena属的嗜盐古菌, 而且还发现了大量的盐湖杜氏藻(Dunaliella)及其分泌的类胡萝卜素等有机质。Sankaranarayanan等[19]基于新的表面消毒策略, 对Schubert等发现的杜氏藻进行了属种鉴定。Winters等[21]利用激光拉曼光谱技术对美国死谷、盐谷和西尔斯盐湖9 ka~1.44 Ma的石盐流体包裹体进行研究, 发现并鉴定杜氏藻分泌的类胡萝卜素成分。最近, 作者利用薄片分析、荧光显微镜观察以及现代卤水蒸发模拟等方法对柴达木盆地千米科学深钻SG-1孔的石盐进行了详细研究[14], 在原生流体包裹体内发现了2.26~0.13 Ma的原核生物和盐湖杜氏藻, 以及覆盖杜氏藻表面的红褐色、橙黄色类胡萝卜素(图2), 并探讨了古嗜盐菌的古生态环境意义。
对SG-1孔石盐岩进行的原位显微镜观察和古嗜盐菌统计分析发现[14]:①古嗜盐菌均分布于常年性盐湖的原生石盐中, 暂时性盐湖的盐盘石盐不含古嗜盐菌, 说明常年性盐湖环境有利于古嗜盐菌的捕获和保存, 盐湖沉积环境对古嗜盐菌的分布有重要影响; ②古嗜盐菌从2.26 Ma到0.35 Ma逐渐增多, 在0.35 Ma后急剧减少, 在0.13 Ma后完全消失, 经历了从繁盛到衰减并最终灭绝的过程; ③钻孔地点的现代卤水蒸发模拟实验揭示, 古嗜盐菌的丰度变化主要受古水活度变化的控制, 并且与蒸发盐矿物序列和亚洲内陆干旱化的演化过程高度一致。柴达木盆地第四纪古嗜盐菌的分布和演化规律表明, 随着第四纪亚洲内陆干旱化的加剧, 柴达木盆地大气降水逐渐减少, 蒸发量逐渐增大, 古盐湖水活度逐渐降低, 导致古嗜盐微生物由繁盛到衰减并最终于0.13 Ma灭绝。该项研究从古气候学和地质微生物学角度提供了极端环境微生物对环境变化响应的例证。
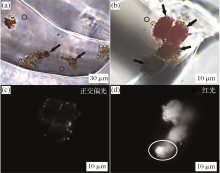 | 图2 柴达木盆地察汗斯拉图凹陷SG-1孔石盐流体包裹体中单细胞盐湖杜氏藻和类胡萝卜素的显微照片[14] (a)类胡萝卜素覆盖的绿色— 黄橙色杜氏藻细胞(粗箭头), 62.3 m (0.18 Ma), 圆圈中的微粒是原核生物; (b)类胡萝卜素覆盖的红色单细胞杜氏藻(粗箭头), 201.7 m(0.45 Ma); (c)覆盖杜氏藻的类胡萝卜素在正交偏光下的双折射现象; (d)图(b)中绿色的杜氏藻(圆圈中)在荧光显微镜下发射红色荧光Fig.2 Photomicrographs of single-celled algae and carotenoids in fluid inclusions in halite from core SG-1[14] (a) Algal cells covered with carotenoids (arrows) in fluid inclusion, depth of 62.3 m (0.18 Ma), small coccoid-shaped cells (circled) are prokaryotes; (b) Red-orange algal cells (arrows) encrusted by carotenoids, 201.7 m (0.45 Ma), small coccoid-shaped cell (circled) is a prokaryote; (c) Carotenoids on surfaces of algal cells are birefringent under cross-polarized light; (d) Greenish algal cell in (b) (circled) autofluoresces using epifluorescence microscopy |
自从地质学家在石盐中发现古嗜盐微生物, 微生物学者对此的质疑就没有停止过, 提出了许多疑问, 并与地质学家展开了长期论战。特别是Vreeland等[6]于2000年在Nature上报道了从美国二叠纪萨拉多组石盐晶体中培养出2.5亿年的芽孢杆菌Bacillus strain 2-9-3, 更是在地质学家和微生物学家中掀起了轩然大波[10, 20, 39~45]。争论的焦点集中在实验流程是否规范、是否存在现代实验室污染、微生物是否能够长期存活、百万年尺度的DNA降解和修复如何进行等。
地质学家Hazen等[39]首先对Vreeland等[6]选取的石盐晶体的原生性进行质疑。认为Vreeland等[6]研究的石盐晶体来自溶蚀空洞的重结晶石盐, 很可能受到后期的地下水溶蚀, 并发生重结晶, 不是二叠纪的原生石盐晶体。因此, 他们指出从该晶体中分离的芽孢杆菌并非2.5亿年的古嗜盐菌, 而是代表了很晚甚至是现代的细菌。一些微生物学家随后发表评论, 认为Bacillus strain 2-9-3与现代死海发现的细菌Virgibacillus marismortui是同种微生物, 认为它源自现代实验室的污染物[40]。然而, Satterfield等[45]对Vreeland等[6]选取的石盐晶体进行了包裹体成分和古温度分析, 并与全球二叠纪古海水成分记录进行比对, 发现这些包裹体中的卤水与二叠纪海水成分是一致的, 并且它们的结晶温度范围为17~35 ℃。这些证据表明虽然Vreeland等选取的晶体可能受到次生改造, 但晶体并未经过重结晶, 其时代仍然为晚二叠纪, 说明该菌株年龄仍为2.5亿年。
Willerslev等[44]认为, Vreeland等[6]以及早期的古嗜盐微生物研究都没有遵循严格的实验室控制规范, 比如在不同实验室内分离和培养Bacillus strain 2-9-3的可重复性。Willerslev等[43]认为如果没有修复机制, 作为一种不稳定分子, DNA将会随时间发生降解。因此, 在2.5亿年的古老石盐中分离和培养出Bacillus strain 2-9-3, 是难以置信的。
为了验证不同微生物实验室之间的可重复性, Schubert等[9, 11]对死谷盆地DV 93-1孔原生石盐进行古嗜盐菌观察和培养, 结果表明他们所鉴定的属种与Mormile等[7]在相同石盐层位发现的古嗜盐菌是相同的, 证明了古嗜盐菌在不同实验室之间具有可重复性。
正如Willerslev等[43]所担心, 如果没有修复机制, 古嗜盐菌在漫长地质时期必然经历DNA降解, 从而无法存活至今。但越来越多的证据发现古代原生石盐的流体包裹体内确实存活大量的古嗜盐菌。这些微生物如何克服DNA降解, 或者说它们如何不断获取能量, 对自身DNA进行修复而保持活性呢?Schubert等[10]和Lowenstein等[20]通过观察美国盐谷和死谷盆地的现代和古代石盐流体包裹体, 发现大多数包裹体内均同时含有原核生物和真核生物。他们认为, 原核生物在密闭的包裹体内可能遵循饥饿— 生存(starvation-survival)适应法则, 通过改变自身形态(如由杆菌状变为球菌状), 减少能量摄入, 并以真核生物(如盐湖杜氏藻)释放的甘油为能量来源, 维持DNA的不断修复, 从而渡过漫长的地质时期。Winters等[22]对死谷盆地DV 93-1分离的嗜盐菌进行室内培养观察。她们发现在缺乏营养的条件下, 杆状嗜盐菌在6周后即可变形为球状菌, 而在营养充足的对照组中, 这些嗜盐菌则保持杆菌形状。这证明某些原核生物在缺乏营养的环境下, 倾向于采用饥饿— 生存适应法则以渡过生存危机。
根据现有证据, 石盐流体包裹体的确能够将结晶母液中的嗜盐菌包裹起来, 并经历漫长的地质时期保存下来。然而, 研究石盐及其他蒸发盐矿物流体包裹体内的古嗜盐菌需要高度重视一些事项, 该领域存在的一些前沿科学问题也值得我们深入思考和探索。
蒸发成因的石盐岩按沉积环境可分为原生和次生成因。一般而言, 我们关注的是原生石盐沉积, 因为原生石盐从常年性盐湖中析出[46], 代表原始卤水的状况。原生的流体包裹体为云雾状、微米级的立方体或矩形, 沿结晶面分布, 呈人字形或在晶体核部密集排列[47, 48]。因此, 这种原生流体包裹体内的古嗜盐微生物才能指示常年性卤水的嗜盐微生物生态系统。相反, 次生石盐形成于成岩后期改造阶段。如果没有明显的上下地层年龄标志, 研究者无法得知其准确的结晶时代。因此, 在缺失准确年龄的情况下, 次生石盐的流体包裹体嗜盐微生物只能代表成岩改造阶段的嗜盐微生物状况, 它们可能是古代的嗜盐菌, 也可能是很晚才被包裹进石盐中的, 不能代表原生的微生物生态系统。
因此, 对石盐等蒸发盐岩开展任何古嗜盐菌研究, 必须首先对蒸发盐岩进行精细的岩相学研究, 包括样品手标本观察、薄片分析等岩相学分析, 综合判定其沉积环境和流体包裹体的成因类型, 选取富含古嗜盐菌的原生流体包裹体开展下一步工作。
开展蒸发盐矿物流体包裹体古嗜盐菌研究, 必须遵守规范的微生物学实验流程和方法。这是因为我们生活在微生物无处不在的环境中, 为了保证分离出的古嗜盐菌真实可靠, 规范的实验流程和方法是必需的。
首先, 在选取理想的矿物晶体后, 需要对其进行严格而规范的表面消毒, 并评价消毒效果[6, 16, 19]。其次, 古嗜盐菌的属种鉴定必须得到不同实验室之间重复实验的验证。由于不同微生物学实验室的实验设备、流程、试剂选择存在差异, 再加上不同研究者对实验技术的掌握、操作规范性等均不相同。新鉴定的古嗜盐菌必须得到不同实验室的重复实验, 才能最终确定其真实有效[42, 44]。
因此, 在提取和鉴定蒸发盐矿物流体包裹体内古嗜盐菌时, 规范而有效的实验流程应该遵循:①在显微镜下挑选富含嗜盐菌的原生流体包裹体的原生矿物晶体; ②然后对这些晶体进行严格的表面消毒, 并验证消毒效果; ③将晶体溶解在无菌超纯水中, 通过浓缩提取有机质的DNA; ④加入嗜盐菌特异性引物, 进行PCR扩增, 对得到的PCR产物进行克隆和DNA测序, 鉴定嗜盐微生物的属种; ⑤在其他微生物实验室进行可重复性实验, 比对实验结果的异同, 从而最终确定嗜盐菌的属种。
4.3.1 其他蒸发盐矿物中的古嗜盐菌
石盐流体包裹体中古嗜盐菌的探索已经相对成熟, 但其他诸如石膏、钙芒硝、天然碱等蒸发盐矿物也是古嗜盐菌研究的潜在理想载体。并且, 这些蒸发盐矿物的溶解度低于石盐, 其原生晶体更易于保存, 理论上更利于寻找古嗜盐菌。
近年来, 石膏晶体流体包裹体中的嗜盐微生物得到学界广泛关注[49~53], 主要原因在于“ 机遇号” 、“ 勇气号” 火星车在火星表面发现了大量的硫酸盐矿物[54~57], 进而激发科学界寻找古代火星生命的热情。Panieri等[49]在意大利北部Monte Tondo采石场的墨西拿期巨型石膏晶体中发现了微小的管状生物遗迹, 将其解释为古嗜盐细菌的残骸。随后的微生物学基因测序分析, 在该石膏晶体中分离出一种5.910~5.816 Ma的蓝藻16 rRNA序列[50]。Benison等[52]对位于智利北部安第斯山的Gorbea和Ignorado盐湖进行考察和研究, 在盐湖结晶的石膏流体包裹体内发现大量的羽状硅藻、蓝藻、和原核生物[51]。此外, 在非洲马加迪湖的天然碱晶体中也发现了丰富的古嗜盐菌[58]。这些发现说明, 在盐度较高的各种水化学类型盐湖中, 不同的蒸发盐矿物均能够提供捕获和保存嗜盐微生物的空间。
然而, 不同于石盐矿物, 研究者在研究石膏、天然碱等蒸发盐矿物时, 大都忽略了这些矿物的沉积环境、晶体结构和包裹体形态, 对判定矿物及其流体包裹体的原生或次生成因不够重视。例如, 在石膏、天然碱等晶体中发现的古嗜盐微生物, 有相当一部分来自晶体边界或者以固体包裹体的形态存在于晶体基质中[51, 52], 导致无法确定这些嗜盐菌准确的生存年代、包裹过程和成因类型。因此, 在研究此类蒸发盐流体包裹体内的古嗜盐菌之前, 查清其矿物结晶的沉积环境、区分原生次生流体包裹体类型等基础地质学问题亟待解决。
4.3.2 更古老嗜盐菌的识别和鉴定
目前已知的最古老嗜盐菌来自于Vreeland等[6]分离培养的2.5亿年的二叠纪芽孢杆菌Bacillus strain 2-9-3。Schubert等[11]通过原位观察、识别、提取、培养和鉴定等手段, 发现了33 ka的Halorubrum, Natronomonas和Haloterrigena等嗜盐菌菌株。对柴达木盆地2.26~0.13 Ma的石盐开展的原位显微镜观察发现了大量古嗜盐原核生物、盐湖杜氏藻及其分泌的类胡萝卜素[14]。然而, 是否在更古老的原生石盐中能够直接观察到, 并提取、培养和鉴定出古嗜盐菌, 仍然值得我们进一步探索。
4.3.3 古嗜盐菌的生存机制
现有的研究表明, 古嗜盐菌可以在封闭的蒸发盐矿物流体包裹体中生存数万[7, 10]、甚至百万年以上[5, 6]。古嗜盐菌如何在这种封闭、缺氧、缺光照、低营养的极端恶劣环境中生存下来?即其生存机制如何, 仍是非常值得关注的科学问题。Schubert等[10]认为古嗜盐菌中的原核生物可以利用真核生物(如盐湖杜氏藻)在极端恶劣环境下释放的甘油等碳氢有机分子作为生命代谢活动所需要的能量物质。某些古嗜盐菌在缺失营养的环境下, 会通过“ 饥饿— 适应” 法则[59, 60], 来最大可能地减少能量摄入, 这一机制也得到了实验室内模拟试验的证实[22]。此外, 部分嗜盐菌, 如芽孢杆菌可以采取产生休眠孢子的方式保存其活性[5, 6], 经历漫长的历史后再次复活。
然而, 无论是盐湖杜氏藻的营养供给、饥饿— 适应法则还是休眠机制对解释古嗜盐菌的生存策略仍存在很多争议和不确定性, 这可能是由于不同属种古嗜盐菌的生命活动存在巨大差异。因此, 如何理解和认识古嗜盐菌在长达百万年时间内依然存活的这一令人惊讶的地质学和生物学奇迹, 依然等待我们孜孜不倦地投入热情去发掘和探索。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|


