作者简介:吴能友(1965-),男,浙江东阳人,研究员,主要从事海洋地质研究工作. E-mail:wuny@ms.giec.ac.cn
钙在海洋中是离子浓度仅次于钠和镁的金属元素,在海洋生物过程及矿物形成中都占据重要的地位。随着同位素分析仪器精度的提高,钙同位素等非常规稳定同位素的研究逐渐成为地球化学的热[JP2]门,钙同位素在海洋环境中的分馏机制及其在古海洋学中的应用研究不断完善。系统介绍了钙同位素高精度分析的方法和原理,海洋环境中无机成因和有机成因2种钙同位素分馏的机制和应用;通过大量的文献调研综述了钙同位素地球化学研究在古海洋参数恢复上的应用。通过有孔虫Globigerinoides sacculifer的钙同位素具有对温度敏感、温感公式简单、后生成岩作用对其影响小和分析材料完整易得等优点,并同其他传统地质温度计联用,为古海洋研究提供精确的海洋表面温度(Sea Surface Temperature,SST);利用钙同位素值温度相关性较小的钙质壳体来恢复古海洋钙通量;利用无机成因碳酸盐岩盖帽的钙同位素恢复海水CO2-3浓度和研究甲烷渗漏对古海洋环境的影响。
The concentration of calcium is only below sodium and magnesium among metalions, which plays a crucial role in biological processes and the formation of minerals. As analytic accuracy has been increasing, studies of calcium isotopes now become hot focus. Fractionation mechanism and paleoceanographic applications of calcium isotopes in marine settings are perfected with time. Globigerinoides sacculifer is the most promising proxy allied with other proxies of sea surface temperature because its calcium fractionation being sensitive to temperature, with simple formulas and resistant to diagenesis and it is also accessible to test. Those who are not sensitive to temperature in fractionation can be used to recover calcium budget. Inorganic calcium carbonates are promising to evaluate the influences that seepage of methane may exert on paleo-climate.
钙离子(Ca2+)在海水的浓度为0.4119 g/kg, 仅次于钠离子(Na+)和镁离子(Mg2+)等氧离子, 在海洋生物过程及矿物形成中都占据重要的地位。钙有6个稳定同位素:40Ca(96.941%), 42Ca(0.647%), 43Ca(0.135%), 44Ca(2.086%), 46Ca(0.004%), 48Ca(0.187%)[1]。
不同于原子质量较小的氧、碳、氢、硫等元素, 由于受到质谱仪器分析精度的限制和对分馏机制认识的不足, 钙同位素的研究相对滞后。Russell[2]运用先进的高精度质谱仪结合“ 双稀释法” (double spike technique)测定了陆源物质、陨石和月壤的钙同位素值, 为钙同位素的地球化学研究兴起奠定了基础。Skulan[3]对钙同位素分馏的生物控制因素进行了研究, 发现生物体钙同位素值差别不大, 但较轻的钙同位素优先进入生物体, 认为生物分馏是自然界钙同位素分馏的主要原因。Zhu[4]发现太平洋赤道地区的全新世与末次盛冰期的Globigerinoides sacculifer有孔虫钙同位素值δ 44/40Ca有0.6‰ 的差值, 并发现钙同位素值与温度或者有孔虫栖息海水深度有关系, 温度越高有孔虫中的重钙同位素越富集[4]。钙同位素分馏的温度相关性使其可能成为自δ 18O、Mg/Ca比、Sr/Ca比和
钙同位素高精度分析方法最先是由Russell[2]提出的, Heuser[5]将双稀释剂改为43Ca/48Ca, 将测试精度提高到0.15‰ 以上。绝大多数钙同位素研究均利用表面热电离质谱(Thermal Ionization Mass Spectrometry, TIMS)进行测试, 也有少数利用多接收器等离子体质谱仪(Multiple Collector Inductively Coupled Plasma Source Mass Spectrometry, MC-ICP-MS)[6~8]。40Ca测试会受到40Ar影响, 所以测试样品的钙同位素用44/42Ca表示。对于运用TIMS测试而言, 样品处理后, 样品用超纯HCl(或者HNO3)溶液溶解, 将样品与43Ca/48Ca双稀释剂混合用以校正仪器内部分馏, 将溶液挥发干后用HCl(或者HNO3)溶液溶解, 用三明治法(样品―活化剂―样品)将溶液与活化剂Ta2O5(或者TaCl5)一起置于真空中逐区精炼的铼丝上。将铼丝加热至约1, 500℃后进行测试, 一般测试至少2次以提高测试准确度。
钙同位素值表示方法跟其他稳定同位素类似, 使用重轻同位素丰度比值与标准样品比值的千分差, 常用δ 44/40Ca和δ 44/42Ca表示[9]:
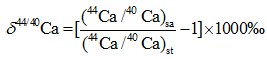 |
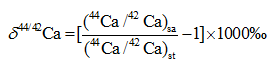 |
式中:(44Ca/40Ca)sa和(44Ca/42Ca)sa表示的是测试样品的重轻同位素丰度比值, 而(44Ca/40Ca)st和(44Ca/42Ca)st表示的是标准样品的重轻同位素丰度比值。现在最常用的钙同位素标准样品是由美国国家标准和技术研究所(National Institute of Standard and Technology, NIST)颁发的NIST SRM 915a, 其44Ca/40Ca = 0.2120[10], 但是美国国家标准和技术研究所已经停止提供SRM915a的样品, 取而代之的是更好的标准物质SRM915b。由于前期所有研究均以SRM915a作为标准物质, 本文δ 44/40Ca均以SRM915a为标准表示。SRM915a和SRM915b标准下的δ 44/40Ca值换算公式如下:
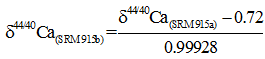 |
Gussone[11]提出了一种新的钙同位素表示方法, 钙同位素值δ muCa表示每一相对原子质量的钙同位素分馏大小:
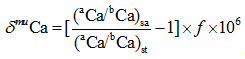 |
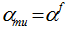 |
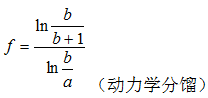 |
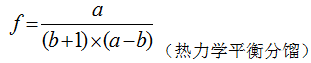 |
式中:a, b分别为重、轻钙同位素的相对原子质量; 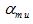
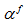
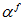
利用这种方法可以将不同重轻同位素比值在同一度量下进行比较, 扩大了重轻钙同位素测试和适用范围, MC-ICP-MS所测的δ 44/42Ca也可用于与TIMS所测的δ 44/40Ca相比较。由于标样有限, 一些质谱内部测试时供参考的标准物质是高纯度的CaF2与SRM915a衔接[11~13]; 也有一些为了简单明了地表示钙同位素与海水的分馏程度, 会将海水的重轻同位素丰度比值作为标准表示δ 44/40Ca。用于NIST SRM915a, CaF2和海水之间换算的钙同位素值千分差如表1所示。
| 表 1 各常用标准之间钙同位素丰度千分差(修改自Gussone[14]) Table 1 Conversion of Ca-isotope data between the common standards(modified from reference[14]) |
与传统的稳定同位素类似, 钙同位素分馏根本上也是受到不同同位素之间质量差异造成的, 分为热力学平衡分馏、动力学非平衡分馏和非质量相关分馏。已报道的钙同位素分馏值随温度升高而变大, 这与碳、氧同位素有明显的差别。厘清钙同位素的分馏机制对于钙同位素地球化学研究及其应用至关重要, 目前对于钙同位素分馏机制仍然没有定论, 无机碳酸盐岩的热力学平衡分馏和动力非平衡分馏都能一定程度上解释目前得到的钙同位素分馏机制, 生物成因碳酸盐岩则受制于更为复杂的生命效应。
3.1.1无机成因钙同位素分馏
Marriott[15]通过培养珊瑚进行钙同位素进行MC-ICP-MS分析后, 认为无机成因CaCO3钙同位素发生分馏是原因是单纯的热力学平衡分馏, 因为①观察到的分馏值(约0.5‰ )远小于理论的20‰ ; ②同位素分馏数据表明Ca2+-H2O络合物水分子数(约50)远超理论值; ③无机方解石钙同位素值随着温度升高而降低。CaCO3钙富集轻同位素的原因是Ca2+-H2O络合物的键能大于CaCO3, 40Ca更倾向于进入晶体, 44Ca则更倾向于留在液相(海水)中[15, 16]。这种单纯的热力学分馏观点缺乏直接证据, 目前研究并不能解释钙同位素分馏的温度相关性, 也不能解释无机Ca同位素分馏与[CO32-]相关而生物成因Ca同位素分馏与[CO32-]无关这一现象。
Schiller[17]通过TIMS和HR-MC-ICP-MS联合测试的方法, 确定海洋中出现的无机成因和生物成因钙同位素分馏是动力学非平衡分馏。Lemarchand[18]认为无机碳酸盐岩的钙同位素分馏不是单纯的热力学分馏或者动力学分馏的结果, 在实验条件下CaCO3沉淀过程中, 水―岩界面有δ 44/40Ca ≈ -1.5‰ ± 0.25‰ 、厚度为0.5 nm平衡分馏区, CO32-的扩散导致扩散区域过饱和系数增大, 外部非平衡钙同位素不断进入狭小的平衡区, 沉积速率越快平衡时间越短, 越多的非平衡钙就会进入晶格[14]。海水中的Ca2+浓度总是过饱和的, 也就是[Ca2+] > > [CO32-]+[HCO3-], 所以控制CaCO3沉淀速率的关键因素是CO32-和HCO3-的浓度。海水中的CO32-浓度又是温度的函数, 所以这种“ 速率控制端元混合” (rate dependent end member mixing, RDEMM)模型能解释无机碳酸盐岩钙同位素分馏的温度相关性。
在海洋地质背景下, 速率控制端元混合模型也能解释文石和方解石的钙同位素分馏差异[11]。Gussone[11]在研究文石和方解石的钙同位素分馏时发现, 海水中CaCO3钙同位素比实验室条件下的δ 44/40Ca值小0.5‰ , 同时实验室条件下的CaCO3沉淀速率是海水中的25倍, 这也与RDEMM模型相符合。实验结果表明文石的δ 44/40Ca值比方解石大0.5‰ , RDEMM模型下对应方解石的沉淀速率是文石的20~25倍, 但事实上文石的沉淀速率是方解石的3倍, 作者认为这可能是由于文石与方解石的振动能差异或者表面化学差异造成的。Bö hm[19]对RDEMM模型进行了数值模拟, 通过建模得到钙同位素δ 44/40Ca值与沉积速率的函数关系:
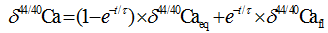 |
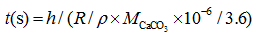 |
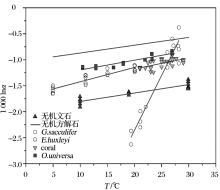
式中:δ 44/40Caeq表示文石或者方解石的平衡钙同位素值, δ 44/40Cafl表示海水的钙同位素值, t表示钙同位素平衡分馏时间, τ 表示平衡时间常数, h表示CaCO3层厚度, R表示沉积速率, ρ 表示文石或方解石的密度, MCaCO3表示CaCO3的摩尔质量。当假设有中间产物存在时, 模拟得到的1000ln(α )―logR曲线与实际测量值拟合得很好(图1)。模拟数据表明当方解石沉淀速率大于文石沉淀速率时, 方解石的钙同位素较文石偏重, 利用RDEMM模型便解释了文石与方解石的钙同位素δ 44/40Ca的差值。
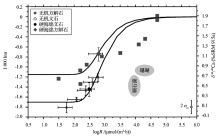 | 图1 速率控制端元混合模型数据图与实测数据比较(修改自文献[19])Fig.1 Rate dependent end member mixing model fits to measured data (modified from reference[19]) |
无论是搅拌还是非搅拌条件下, Lemarchand[18]的实验数据表明钙同位素分馏程度随碳酸钙沉积速率变大而变小; 而Fantle[20]发现太平洋西部的翁通爪哇高原(Ontong Java Plateau)北脊的碳酸盐岩钙同位素分馏值并不符合Lemarchand[18]的实验数据。在10-19~10-18 mol/(m2· s)的较低沉积速率下, 该站位钙同位素相对于海水的分馏值在0左右, 而Lemarchand[18]分馏值为0对应的沉积速率为10-5~10-4mol/(m2· s)。Tang[21, 22]对人工合成的方解石进行钙同位素测试发现了与Lemarchand[18]完全相悖的结果, 钙分馏程度随沉积速率变大而变大。如果平衡分馏系数α s-f~1, 晶体生长模型和晶体表面动力学模型可以解释该同位素分馏值与沉积速率呈负相关变化的现象。Fantle[23]认为在不同沉积速率情况下晶体沉积— 溶解速率的分异造成了α s-f与沉积速率的相关性, 速率控制模型的结果是因为晶体表面反应引起了水―岩界面的蒸馏效应(Distillation Effect), 从而导致正相关的出现。而DePaolo[24]和Nielson[25]的研究表明溶液的水动力学性质对于分馏值与沉积速率的正相关起到了重要作用。Harouaka[26]人工培养的石膏钙同位素表明, 在搅拌反应条件下, α s-f与溶液初始状态的过饱和度和沉积速率无关联; 而在非搅拌条件下, α s-f与沉积速率表现正相关的关系。Harouaka[20]认为这是由于石膏晶体不同晶体面的分馏系数差异造成的。石膏晶体(001)面的表面能为5 138 kJ/mol、(100)面的表面能为3 563 kJ/mol、(010)面的表面能为499 kJ/mol, 为了降低晶体总表面能, 晶体倾向于在较高表面能(沉积速率)的晶面生长, 因此在(010)晶体面结晶的Ca相对于其他面则会表现出更小的分馏。而石膏全岩的钙同位素分馏值是由各个晶体面钙同位素分馏值的加权平均:
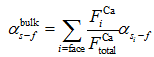 |
式中:i表示晶体生长面,
3.1.2 生物成因钙同位素分馏
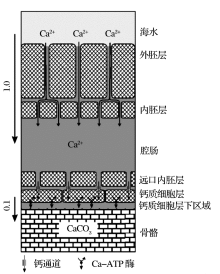
RDEMM模型无法解释G.sacculifer钙同位素温度相关分馏, 也不能解释O.universa、石珊瑚和颗石藻的钙同位素值与CO32-浓度并无明显的关联[19, 27, 28]。目前, 学界一致认为控制生物成因钙同位素分馏的主要是生物过程, 海水内吞作用、ATP酶选择性吸收、钙化通道等都被认为是控制钙同位素分馏的因素, CaCO3在钙化点没有发生分馏, 但是对于钙运输和分馏机制仍然有较大分歧。Gussone[28]和Bö hm[19]认为钙同位素分馏发生在细胞膜选择性吸收过程中。石珊瑚钙化细胞下的钙化流体与海水隔绝, 其细胞层下空间只能维持几秒的钙沉淀, 所以钙化流体必须以非常高的速率进入有机体(图2)[19]; 钙―水合物在颗石藻细胞膜外便发生水解, Ca2+通过钙选择性吸收通道进入细胞液, 再重新水合运输到高尔基体进行钙化。Kisakurek[29]和Griffith[30]则认为生物体钙化是通过内吞作用在细胞内形成钙库(Ca pool), 而钙化过程是一个瑞利分馏过程。海洋中典型的钙化生物如颗石藻和珊瑚等的钙同位素分馏函数与无机碳酸盐岩钙同位素分馏函数斜率相近(图3), Gussone[27]认为两者的分馏机制与无机碳酸盐岩无异。
颗石藻通过细胞膜主动运输吸收钙离子, 钙离子通过高尔基体发达的膜系统将钙离子运输到钙化点, 最后将钙质壳体运输到细胞表面; O.universa的细胞质中的没有钙库, 但是钙化有一定延迟效应, 因此O.universa可能先将海水内吞并直接储存在钙化液泡中, 液泡对海水进行化学改造并直接在液泡内钙化[31]; 对于珊瑚而言, 海水首先储存在腔肠中, 钙化细胞通过ATP酶选择性吸收腔肠中海水的钙, 在钙化细胞下部形成钙化流体, 之后钙离子与有机物结合最终形成壳体。总之, 这些生物体在进行膜运输时即发生钙同位素分馏, 而钙沉淀过程中不发生分馏。Ca2+与ATP酶结合的原理同无机CaCO3沉淀时的原理类似, 而钙同位素温度相关分馏可能是ATP酶活性与轻重同位素结合受温度影响的结果, 这也能解释O.universa、石珊瑚和颗石藻的钙同位素值与CO32-浓度并无明显的关联。
Griffith[13]在One-box模型[32]的基础上用瑞利分馏解释Globigerinoides ruber等浮游有孔虫的钙同位素分馏机制, 将其称为动态钙库(dynamic Ca pool)模型。模型计算的前提是:①钙同位素分馏是温度相关的; ②钙化过程中钙化液泡中钙的剩余百分数小于1。根据瑞利分馏结合质量守恒定律, 得到等式(11), (12)和(13):
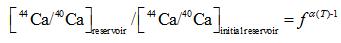 |
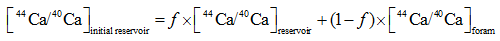 |
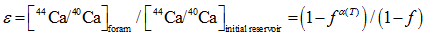 |
式中:reservoir表示的是钙库中钙同位素值的实时值, initial reservoir表示的是钙库中的初始钙同位素初始值, foram表示的是有孔虫钙同位素的实测值, f表示钙库中剩余Ca的百分比, α (T) = 0.9985 +0.00002× T(℃), f = 85%。得到了钙库初始同位素值, 水体上层捕捞的有孔虫为-0.84‰ , 而沉积物中有孔虫为-0.95‰ , 相对于海水仍然亏损44Ca。如果不考虑参数选择上带来的误差, 这也从一定程度上证实了钙同位素在通过细胞膜时便发生了分馏或者海水成分在钙库(细胞质)中发生了变化, 可能是因为ATP酶更偏向于与轻同位素结合或者Ca通道优先让轻同位素通过。Kisakurek[29]将δ 44/40Ca与Sr/Ca比结合起来, 运用瑞利分馏模型计算有孔虫G.ruber和Globigerinella siphonifera钙库中钙的利用率。如果钙库与海水成分一样, 那么G.ruber的f=0.81~0.92、G.siphonifera的f=0.76~0.92, 这就意味着钙库中只有不到25%的钙用于沉淀结晶; 如果钙库与海水有0.2‰ 的分馏(δ 44/40Caresearvoir = δ 44/40Caseawater - 0.2‰ ), 那么G.ruber的f= 0.63 ~ 0.74、G.siphonifera的f= 0.58 ~ 0.72, 仍然不到50%的钙用于沉淀结晶。总之, 浮游有孔虫的钙库是一个半开放系统, 矿化点与海水不是完全隔离, 而是受到了网状伪足的限制, 与海水有物质交换并且经机体改造的矿化液搬运至钙化点产生CaCO3。
上述模型都不能解释袋拟抱球虫的钙同位素分馏特征。袋拟抱球虫(Globigerinoides sacculifer)是一种广泛应用于碳、氧和Mg/Ca比等稳定同位素测定的浮游有孔虫。Zhu[4]发现太平洋赤道地区的全新世与末次盛冰期的G.sacculifer钙同位素δ 44/40Ca值有0.6‰ 的差值, Nä gler[33]人工培养的和Hippler[34]海水表层拖网的G.sacculifer钙同位素分馏值分别表现出0.24 ‰ /℃和0.22 ‰ /℃的温度相关, 使其成为恢复古海洋SST最具潜力的指标。但是Sime[6]和Griffith[30]却发现G.sacculifer的钙同位素分馏值表现出很小温度的相关性(约0.013 ‰ /℃)。这说明影响G.sacculifer钙同位素分馏并非简单的热动力学分馏, 而是有更为复杂的生物分馏过程。Gussone[28]认为G.sacculifer的钙同位素分馏值对温度变化更为敏感, 则是因为钙沉淀时是以Ca2+的形式存在, 而不是Ca· [H2O]n2+, 这表明钙―水络合物的可逆反应对碳酸钙形成的总包反应速率起到了决定性作用, 但是作者并没有直接证据或者模型证实他的猜想。虽然G.sacculifer有钙库[35], 但Griffith[13]的动力学钙库模型没有解释钙同位素分馏值0.24‰ /℃相关性的原因, 其次Elderfield[32]的One-box模型适应于底栖有孔虫而不是更为复杂的浮游有孔虫。对于G.sacculifer有孔虫的钙同位素值分馏值温度相关性表现的巨大差异[6, 27, 28, 30, 33, 34]。Gussone[14]利用Bimodel模型解释了不同盐度下G.sacculifer钙同位分馏的差异, 也就是钙化流体是内吞作用和钙库双重来源混合的模型[14], 根据等式(14), (15)和(16), α , [44Ca/40Ca], f和r可以得到表2中的数据:
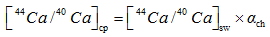 |
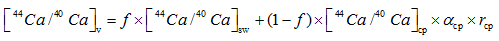 |
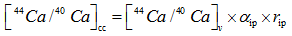 |
| 表 2 Bimodel模型计算参数 Table 2 Applied variables for Bimodel |
3.2.1 温度
温度是影响海洋中无机成因和生物成因钙同位素分馏最主要的因素, 也是同位素分馏值方程的基石。1000lnα cc-sw与温度有较好的线性关系(图1), 其中G.sacculifer钙同位分馏值方程的斜率是其他CaCO3分馏值方程的斜率的9~16倍(α =Rmineral/Rseawater, 温度T单位为℃, 下同)。
方解石[11]:
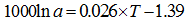
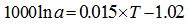
文石[11]:
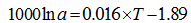
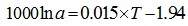
G.sacculifer[32]:
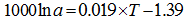 |
O.universa[27]:
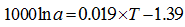 |
E.huxleyi[26]:
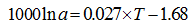 |
石珊瑚[19]:
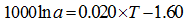 |
3.2.2 海水化学性质
Lemarchand[18]将钙同位素分馏差异归因于沉积速率, Gussone[11]认为沉积速率取决于CO32-的浓度, 从而将温度又与海水中的CO32-的浓度成函数关系, 所以直接得到分馏值与CO32-浓度的关系:
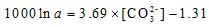 |
得到的分馏方程斜率实验值一样, 但1000lnα 偏高0.5‰ 。对于生物成因的CaCO3而言, 由于生物体溶解无机碳(Dissolved Inorganic Carbon, DIC)供给受温度影响较小, Gussone[27, 28]发现CO32-浓度对O.universa和E.huxleyi同位素分馏值影响可以忽略不计。除了CO32-外, 海水中的Mg、SO42-等也可能抑制无机成因CaCO3的沉淀速率[11]。
G.sacculifer的钙同位素分馏方程差异可能是海水盐度造成的。夏天河流输入量大, 降低了表面海水的盐度, 导致50~70 m之间有一个盐跃层, 其中的生物组成与临近水体不同[36], 趋高度盐的G.sacculifer可以通过控制壳体的形状或质量向高盐度的深海迁移。说明G.sacculifer在高盐度环境的生长速率可能高于低盐度环境, 相应的钙库大小及其充填参数、ATP酶活性对温度的敏感性等也会发生改变。Nä gler[33]对有孔虫进行人工培育, 其盐度为34.5~36 psu, 属于较高盐度, 得到0.24 ‰ /℃的温度相关斜率; Gussone[28]将有孔虫置于盐度为33~34.5 psu的海水中人工培养, 得到0.017‰ /℃的温度相关斜率。因此Sime[6]和Griffith[30]得到的G.sacculifer的钙同位素分馏值表现出很小温度的相关性(约0.013 ‰ /℃)可能是有孔虫在低盐度下生长造成的。Lemarchand[18]在实验条件下记录无机钙同位素分馏受到盐度的影响, 在Σ CO2= 2 mmol/L、温度为21℃、pH=8.2条件下, Δ 44/40Ca与盐度的斜率为0.01 ‰ /psu。
3.2.3 壳体性质
配子生殖也可能是对有孔虫壳体钙同位素分馏的影响因素。浮游有孔虫在繁殖过程中会从浅部海面潜往更深海域, 并在个体成因壳体(ontogenic layer)的基础上分泌出新的配子成因层(gametogenic layer)。这2种不同时间和条件下分泌的钙质层, 同位素有显著差异。Globorotalia tumida的个体成因钙层同位素值(1.8‰ ± 0.3‰ )比配子成因钙层同位素值(-1.9‰ ± 0.2‰ )大, 而Globorotalia Truncatulinoides与之相反, 其个体成因钙层同位素值(-1.4‰ ± 0.4‰ )比配子成因钙层同位素值(0.2‰ ± 0.1‰ )小[7]。Gussone[14]发现沉积物拖网的G.sacculifer产生了配子成因层, 其钙同位素分馏方程斜率小; 而海面拖网的G.sacculifer没有配子成因层, 其钙同位素分馏方程斜率大; 但沉积柱中产生了配子成因壳体的G.sacculifer的钙同位素分馏方程斜率大, 这可能是后期成岩作用去除了配子成因壳体。另外, 后期成岩作用中不会使钙同位素再次分馏[33], 钙同位素分馏值与壳体大小也有一定关系[37]。
相对于常用于古海洋SST恢复的指标δ 18O和Mg/Ca比而言, 有孔虫壳体中的钙同位素分馏有不受pH值、CO32-浓度、后期成岩作用等的影响以及古海水δ 44/40Ca值易恢复等, 使其成为热门的SST潜在指标。Zhu[4]发现太平洋赤道地区的全新世与末次盛冰期的G.sacculifer钙同位素δ 44/40Ca值有0.6‰ 的差值, Nä gler[33]人工培养的和Hippler[34]海水表层拖网的G.sacculifer钙同位素分馏值分别表现出0.24‰ /℃和0.22 ‰ /℃的温度相关。由于海水成分相比实验营养液更为复杂, Sr, Mg和SO42-等都会对钙同位素分馏产生影响, 同时数据表明实验条件下恢复的温度与实际地质背景下有2.5℃的差值[12]。
Gussone[12]利用G.sacculifer钙同位素、Mg/Ca比和氧同位素重建了上新世加勒比海SST及盐度变化对中美洲环流的响应。在4.0~4.2 ma间3个指标恢复的SST趋势类似; 4.4~4.7 ma间3个指标恢复的SST几乎一样; 然而4.2~4.4 ma间与δ 44/40Ca恢复的SST相比, Mg/Ca呈现出较低SST, 而δ 18O较大差值且变化趋势相反。由于δ 18O受到温度、盐度和冰量的共同影响, Mg/Ca也容易受到温度和盐度的影响, 因此推断加勒比海水盐度在4.2~4.4 ma间处于较低时期。这是由于热带辐合带增强了巴西北部洋流运动, 将低盐度的海水输送至加勒比海, 从而导致海水盐度降低。
| 表3 G.sacculifer钙同位素测温方程 Table 3 Temperature equations of calcium isotopes fractionation of G.sacculifer |
Hippler[34]利用G.sacculifer钙同位素、Mg/Ca比和氧同位素重建了MIS1~6期间大西洋赤道地区的海水表层温度, LGM与全新世SST有2.5~3.5℃的差值, 这与Mg/Ca比的(2.6± 1.3)℃[38]、δ 18O的2.0~3.0℃[39]、
但是Sime[6]和Kasemann[7]也发现包括G.sacculifer在内的12种有孔虫的钙同位素表现出与温度极小的相关性, 因此对G.sacculifer用于SST代理指标产生了质疑; 前者运用的是MC-ICP-MS测试δ 44/42Ca, 经转化公式(δ 44/40Ca = δ 44/42Ca× 2.1001)计算得到; 后者运用二次离子质谱测试δ 44/40Ca, 他们的实验方法与Hippler[34], Gussone[27, 28, 37], Nä gler[33]和Zhu[4]等最大的不同在于测试方法, 事实上现有的温度相关分馏的发现都是由TIMS测试δ 44/40Ca得到的。另外Sime[6]用于判断钙同位素温度相关分馏的SST是由δ 18O推算得到, 鉴于δ 18O作为绝对温度指标的缺陷, 将其用于判断δ 44/40Ca分馏与温度相关性的有效程度仍存有疑问。就目前大部分研究结果看, 相比传统地质温度计而言, 钙同位素作为地质温度计有一定的优势。真正制约G.sacculifer用于恢复SST的是盐度, 在高盐度和低盐度下的温感公式可能存在较大差异, 因此将盐度与钙同位素分馏值的关系进行量化或识别高盐度和低盐度下G.sacculifer壳体鉴定特征, 是将钙同位素可靠地作为SST恢复指标的关键。
海水中的钙同位素值不会随海水深度变化[10], 无论浮游生物壳体还是底栖生物壳体, 抑或无机成因的碳酸盐岩都可用来恢复古海洋δ 44/40Ca值, α cc-sw受温度影响越小越好。O.universa在10~30℃之间δ 44/40Ca值仅变化0.5‰ [14], 因此可作为理想的古海水δ 44/40Ca值恢复指标。腕足类壳体的钙同位素温度相关分馏仅为0.015 ‰ /℃, 也可以用作恢复古海水δ 44/40Ca值代用指标[41, 42]。
利用钙同位素, Zhu[4]认为海洋钙输入输出不平衡, 而Schmitt[10]则认为海洋输入输出是平衡的。Fantle[43]对海洋近2 000万年的钙变化每200~400万年一个周期, 且海洋中钙的输入和输出是不平衡的。Farkas[42]分析了奥陶纪到今生的280个双壳类动物的壳体钙同位素的分馏值并利用海洋钙循环同位素质量平衡(公式(26))发现, 显生宙以来同位素变化的不仅仅是因为海洋含钙流体输入量和输出量的变化, 还因为地壳运动导致地壳与海洋进行离子交换。显生宙以来海水钙同位素值从1.3‰ 增加到2.0‰ , 期间有几次较大的变化, 这种变化主要是因为地壳运动导致海底热液与海水的相互作用对海洋的矿物学性质产生了最终的影响[41]。α cc-sw的模拟和实测数据都表明, 显生宙的钙同位素组成曲线变化与方解石―文石海[44]的出现规律类似, 后者则与Mg/Ca比呈镜像关系。海洋出现文石海— 方解石海交替的现象, 直接原因是文石与方解石的钙同位素分馏差异造成的, 而根本原因是地壳构造运动。海洋中钙同位素值变化的是海水长期受到“ 文石海” 和“ 方解石海” 交替变化的影响的结果。
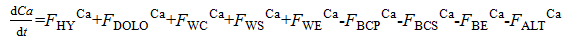 |
式中
海水中二氧化碳―碳酸盐体系的反应平衡如公式(27)所示, 只需要得到pH值、碱度、总碳和pCO2等其中的2个参数, 就可以利用(28)式准确描述无机碳体系。
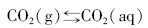 |
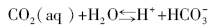 |
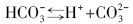 |
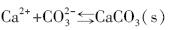 |
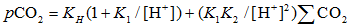 |
式中:KH为亨利常数, K1和K2分别是碳酸一级和二级电离平衡常数。Kasemann[45]分析了纳米比亚新元古代碳酸盐岩盖帽的δ 13C, δ 18O, δ 44/40Ca和δ 11B, 利用δ 11B恢复海水的pH值, δ 44/40Ca恢复了新元古代“ 雪球地球” 前后海水的CO32-浓度, 由此计算出冰消期大气的pCO2。当pH≈ 7时, pCO2≈ 0.09 atm, 是现在地球pCO2的240倍, 也与“ 雪球地球” 假说的0.12 atm接近。另外, 在冰消早期的Keilberg构造中的碳酸盐岩δ 13C = -2.56‰ ~ -3.01‰ , δ 11B= -3.3‰ ~ -5.5‰ , 明显地低于冰期前的Ombaatjie构造, 这也为海底沉积物中的甲烷渗漏增强了新元古代冰消作用[46]提供了证据。
Gussone[12]在G.sacculifer钙同位素只受温度影响的前提下, 利用δ 44/40Ca得到恢复了因盐度和(或)全球冰量变化导致的古海水δ 18O变化值公式:
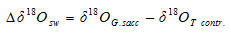 |
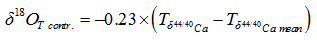 |
式中:Δ δ 18Osw表示古海水δ 18O变化值, δ 18OG.sacc表示G.sacculifer的δ 18O值, δ 18OT contr. G.sacculifer温度导致的δ 18O值, Tδ 44/40Ca表示G.sacculifer钙同位素恢复的SST, Tδ 44/40Ca mean表示G.sacculifer钙同位素恢复的一段时期内SST的平均值。利用δ 18O与盐度的关系, 还可以进一步评估全球冰量变化对海水δ 18O值的影响。
冷泉是海洋沉积物以下由水、碳水化合物、硫化氢和细粒物质组成的流体, 其温度与环境水温度一致, 多出现在主动和被动大陆边缘[47]。冷泉中的碳水化合物在上升过程中, 受到细菌分解作用产生CO2进而产生自生碳酸盐岩[48]。碳水化合物在孔隙、裂隙和断层系统中聚集, 一定温度压力条件下就可以形成甲烷水合物。二叠纪/三叠纪界线处海相碳酸盐岩碳同位素的异常低值可能是天然气水合物失稳释放甲烷造成的[49]; 新元古代的冰川覆盖至赤道地区, 该时期遍布全世界各地的碳酸盐岩盖帽δ 13C(PDB)最低至 -41‰ [50], 同时“ 雪球地球” 假说认为地球当时的CO2浓度高达0.12 atm[45]; 格林兰和北极第四纪冰消期的冰芯也发现了甲烷浓度异常[51]。Kennedy[46]因此认为海洋甲烷水合物失稳对冰期终结有放大器(amplifier)的作用。Kasemann[45]将钙同位素和硼同位素结合反演了大气pCO2, 为甲烷渗漏加速终结新元古代“ 雪球地球” 提供了证据。Bö hm[19]也建立了端元混合模型解释了无机碳酸盐岩的分馏机制, 钙同位素分馏本质上是由于CO32-浓度决定的沉淀速率控制的。结合速率控制两端元混合模型和温度与CO32-浓度关系, Gussone[11]提出了钙同位素分馏值与CO32-的浓度的函数关系:
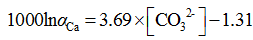 |
利用公式(25), 分析出露的碳酸盐岩盖帽或者海水―沉积岩界面的甲烷礁CaCO3钙同位素值, 就可以反演甲烷渗漏期次、甲烷厌氧氧化的强度和甲烷通量等信息。甲烷厌氧氧化作用会导致沉积物中的自生碳酸盐岩沉积, 文石和方解石沉积过程中更为富集40Ca, 尼日尔三角洲(Niger Delta)沉积物的孔隙水δ 44/42Ca[52]表明, 表层沉积物到甲烷厌氧氧化界面孔隙水的44Ca逐渐富集, 甲烷厌氧氧化界面下部44Ca逐渐亏损, 因此认为孔隙水钙同位素变化可以用来指示甲烷厌氧氧化。Wang[53]也发现了在南海北部冷泉区的自生碳酸盐岩钙同位素值随深度变化。但是也有报导称冷泉区沉积物孔隙水的钙同位素对甲烷活动的指示作用仍有疑问Teichert[54]发现卡斯卡迪亚大陆边缘(Cascadia Margin)沉积物孔隙水钙同位素与钙浓度并不相关, 推断可能是浅部有机物分解或者深部流体所带来的轻钙完全掩盖了自生碳酸盐岩形成产生的孔隙水重钙富集效应, 特别是沉积物上部100 m的孔隙水主要受到有机物再矿化作用影响而不是自生碳酸盐岩的沉淀。
钙同位素作为非常规稳定同位素, 其在低温(海洋)背景下的分馏机制及其应用的研究不断完善, 使其成为一种潜在古海洋物理化学性质恢复指标。钙同位素分馏机制及其影响因素是钙同位素运用于古海洋学的基础。“ 速率控制端元混合” 模型则解释了海洋背景下无机成因碳酸盐岩钙同位素分馏的温度相关性, 以此还建立了CO32-与钙同位素分馏的数学关系。生物成因钙同位素分馏的主要是生物过程引起的, 海水内吞作用、ATP酶选择性吸收、钙化通道等生物都被认为是控制钙同位素分馏的因素, 而CaCO3在钙化点不会发生分馏; 对于更为复杂的G.sacculifer, 其钙同位素分馏相关性被认为是内吞作用和细胞膜选择性吸收多源混合的结果。有孔虫G.sacculifer的钙同位素最有潜力应用于地质温度计, 具有对温度敏感、温感公式简单、后生成岩作用对其影响小和分析材料完整易得等优点。钙同位素与其他传统地质温度计联合使用能为古海洋研究提供精确的SST和盐度数据。虽然数项研究成功地将钙同位素运用于古海洋温度计, 但是盐度对于G.sacculifer钙同位素温度分馏是否有明确的影响仍存疑, 需要更为细致的人工培养环境下的研究来量化盐度与G.sacculifer钙同位素的关系。钙同位素值温度相关性较小的生物钙质壳体则可以用来恢复古海洋钙预算, 恢复大时间尺度下海洋地质活动。无机成因碳酸盐岩盖帽的钙同位素还可能用于研究甲烷渗漏古环境的影响。总之, 随着分析精度的提高、分析方法的简化、分馏机制的不断完善, 无论是单独使用还是与其他指标联合使用, 钙同位素将成为古海洋研究更为完善有效的工具。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|