作者简介:黄邦钦(1964-),男,福建闽清人,教授,主要从事生物海洋学、海洋生态系统与全球变化研究. E-mail: bqhuang@xmu.edu.cn
海洋生物泵及其与碳循环关键生物地球化学研究是当今全球变化研究的前沿课题。边缘海是全球海洋的重要组分,在生态系统的物质循环、能量流动和气候调节中起着十分重要的调控作用,同时也是海洋生态系统和生物地球化学过程相互作用研究的热点和难点区域。针对“边缘海浮游生物群落结构如何调控生物泵效率”这一科学命题,归纳分析了浮游生态系统主要生物组分及其在碳循环和生物泵(颗粒有机碳输出)过程中的作用,总结了当前国内外相关研究进展和存在的问题。目前大多数的研究思路是将整个浮游生态系统看成黑箱模式,关注该生态系统某些方面的动态与生物泵效率的关系。最新研究表明,浮游生态系统对生物泵的调控并不是简单的线性关系,该系统内不同营养级间的碳流与颗粒有机碳输出的相关过程非常复杂。简单地利用浮游生物不同类群(含营养级)生物量和生产力等指标来阐明浮游生态系统结构和生物泵效率的耦合机制非常困难。针对当今存在的问题,提出从整个浮游生态系统入手,在研究生态系统群落组成和生物量(即各类群颗粒有机碳储库)的基础上,更加关注有机碳在不同营养级之间的转换过程及其速率,期望阐明影响生物泵效率的关键生物地球化学过程和机制,同时构建不同浮游生态系统的碳流传递过程和颗粒有机碳的输出模式,从而最终揭示浮游生物群落结构调控生物泵效率的问题。
Biological pump study, coupling with carbon biogeochemical cycle is the hot issue of current global change research. Marginal sea is an important component of the world's oceans, playing key roles in the regulations of nutrient cycling and energy flow, as well as climate regulation, which makes it the hotspot of studies on marine ecosystems and biogeochemistry. Based on the scientific question of “how planktonic community structure regulates biological pump efficiency in the marginal seas”, this review paper described the roles that main biological components of planktonic ecosystem play in regulating both biological pump (that is particulate organic carbon (POC) export) and carbon flow, and summarized progresses that have been made so far as well as problems remain in the field. The idea of most previous studies is to take the whole planktonic ecosystem as a black box, focusing on only parts of the ecosystem ( e.g. physical processes, biological production, community structure and so on) to deduce the relationships between these dynamics and efficiency of biological pump. Recent studies also indicated that how planktonic ecosystem regulates biological pump was not simple or linear as the process of how carbon flow among different components within the ecosystem acts on POC export are very complex. In order to address the current issues, we come up with the idea that takes the whole planktonic ecosystem as a unit, investigating community composition, biomass, as well as key carbon transfer conversion rates among different trophic levels. We aim to reveal key processes influencing the efficiency of biological pump, and establish the coupling models of carbon flow and POC export for different planktonic ecosystems, and thus eventually explain how planktonic community regulates biological pump efficiency in the marginal seas.
当前, 整个地球生物圈都受到全球气候变化的影响。海洋生态系统对于全球气候变化的响应非常敏感, 同时对整个地球系统的气候变化有重要的调控作用。自1990年3月IGBP的核心计划“ 全球海洋通量联合研究” (JGOFS-Joint Global Ocean Flux Study: 1990-2002)正式确定并开始实施以来, 人们研究和了解控制碳及有关生源要素通量变化的过程, 估计其与大气、海底和陆架三者间的交换以及海洋对大气中CO2的吸收、储存和转移能力, 预测大气CO2含量的发展趋势。边缘海(marginal sea)是位于大陆和大洋边缘的海洋, 其一侧以大陆为界, 另一侧以半岛、岛屿或岛弧与大洋分隔。与大洋相比, 边缘海具有空间梯度大、潮波系统和环流结构复杂、各种过程变化剧烈和海陆相互作用明显等特点。边缘海是陆地与开放大洋的连接带, 相对于开放大洋, 边缘海资源丰富且生物生产力水平较高, 生态系统类型多样, 生物群落组成复杂, 受人类活动影响也非常显著。虽然边缘海面积仅占全球海洋总面积的8%, 其初级生产却是全球总初级生产的19%~28%[1, 2]。于此同时, 边缘海对大气CO2的源汇作用是碳循环研究中最基础也是最重要的部分, 它的强弱反映边缘海对气候变化的调节能力, 在全球碳循环“ 丢失项” (missing term or missing sink)的问题被提出后, 边缘海对大气CO2的源汇作用成为平衡全球CO2收支不确定性因素之一引起热议[2]。 因此边缘海生态系统与人类社会息息相关, 其资源环境效应, 特别是重要生源要素的循环对全球碳收支和气候变化具有不可忽略的作用。
另一方面, 随着人们对全球碳循环过程的了解, 海洋“ 溶解度泵” 、“ 化学泵” (碳酸钙泵)“ 生物泵” 、“ 硅泵” 和“ 微型生物碳泵” 等控制机制相继被发现[3, 4]。一般认为, 相对于物理泵(溶解度泵)和化学泵来说, 生物泵的效果更为显著, 在石化燃料大量使用的今天也有着更特殊的意义。海洋生物泵(或生物碳泵)即海洋浮游植物通过光合作用将无机CO2合成颗粒有机碳(POC, 即浮游植物细胞), 通过浮游动物的摄食和颗粒物(如大粒级生物个体、动物粪便等)沉降等一系列复杂过程将POC从海洋上层输出真光层的过程。浮游植物光合作用合成的有机碳绝大部分通过分解作用返回到真光层海水中, 每年仅约有5~15 GtC(约占初级生产力的1%~10%)从海洋上层移出真光层[5]。模型研究显示, 如果生物泵关闭, 那么大气中的CO2浓度将再升高200× 10-6 [6]。毫无疑问的是, 浮游生态系统的各个组成部分(浮游植物、浮游动物和细菌等)在生物泵过程中都扮演非常重要的角色。首先, 海洋浮游植物只占不到全球生物量的1%, 却贡献了近50%的初级生产(固碳)[7]。它们将大气中的CO2通过光合作用转变成POC的形式固定下来, 还控制着氮、磷等关键生物地球化学元素的循环过程。于此同时, 浮游生态系统的其他过程也显著影响着生物泵的效率, 即被浮游植物固定下来的CO2有多少能够最终被储存在相对稳定的碳储库中(如埋藏在海底, 变成不易降解的形式等)。因此在全球气候变化背景下, 研究海洋浮游生态系统在调节地球系统, 特别是边缘海的初级生产、有机碳沉降、摄食和呼吸作用等生物泵关键过程在海洋碳循环中的作用显得尤为重要和紧迫。
颗粒物大小是直接决定颗粒沉降速度的一个重要参数, 微米级的浮游植物细胞其沉降速度通常小于1 m/d, 而毫米级的大颗粒则每天可下降数百米[8]。硅藻、甲藻和颗石藻等细胞粒径较大或密度较高的浮游植物, 透明多聚颗粒(Transparent Exopolymer Particles, TEP)和浮游动物粪便(fecal pellets)等都具有较高的沉降速度[9, 10]。已有的研究结果表明, 沉降速度较高的硅藻是陆架区沉降生物的主要成分, 以硅藻为主的生态系统其生物泵效率也较高。如在地中海部分海域, 硅藻为优势类群, 生物硅(BSi)与POC存在良好的耦合关系, 海洋表层生成的BSi向底层输送的效率达到62%, 且随着深度的增加而上升[11]。另外在硅藻藻华后, POC通量都会显著增加[12, 13]。颗石藻虽然粒级较小但密度较大, 也是一类贡献POC输出的重要浮游植物功能类群[14]。有研究表明, 在低纬度海区, 颗石藻是层化水体中浮游植物优势类群之一[15], 另外在某些近岸上升流海区, 颗石藻也能成为主要类群之一[16]。最为典型的赫氏颗石藻(Emiliania huxleyi)的沉降速率大约在1 m/d[17], 而且被浮游动物摄食打包之后的沉降速率能够超过100 m/d, 最大可以达到250 m/d[18]。
经典理论认为, 微微型浮游植物(picophytoplankton)沉降速度较慢, 死亡的细胞容易被降解, 因此以微微型浮游植物为主的系统, 其物质循环主要在上层进行, 颗粒较少能输出到真光层以外, 因此生物泵效率较低[19]。然而, 也有研究发现蓝藻(主要是聚球藻Synechococcus)和其他微微型浮游植物能够通过其他方式被动地输出到深海[20]。通过逆模型分析表明, 微微型浮游植物可通过多种途径来提高其最终POC输出[21], 其一是可以形成聚集体(aggregation)直接提高沉降速度, 其二是通过被摄食进入微型食物环, 再通过微型浮游动物(microzooplankton)或更高营养级的中型浮游动物(mesozooplankton)等的粪便和尸体的沉降输出, 来提高生物泵效率。他们的研究表明, 海洋浮游植物对碳沉降的贡献与单个细胞的大小并不明显相关, 赤道太平洋微微型浮游植物对输出生产力贡献可达到76%以上, 在阿拉伯海可达到75%以上, 与其对净初级生产力的贡献是一致的。另外, 新西兰东侧的高营养盐低叶绿素海区(high nutrient and low chlorophyll, HNLC)海底沉积物也发现大量微微型浮游生物聚集体[22]。在贫营养盐的北大西洋马尾藻海, 通过大体积原位泵采集真光层以下的海水, 也发现了最新的支持微微型浮游植物贡献输出的证据: 在500 m的深度发现聚球藻、原绿球藻和微微型真核浮游植物的特征光合色素, 这3类小粒级的浮游植物分别贡献了2%~13% (5%± 4%), 1%~20% (5%± 7%) 和 6%~43% (23%± 14%) 的POC输出(基于沉积物捕获器的结果)[23]; 我们在南海北部海盆的研究结果也显示, 微微型浮游植物可输出真光层(未发表)。总之, 作为贫营养盐海域的最主要的初级生产者— — 微微型浮游植物在生物泵中扮演的角色仍然存在较大的争议[24]。目前, 人们关于微微型浮游植物对生物碳泵输出通量的认识可能是不全面的。
浮游动物被认为是海洋中控制浮游植物生物量和群落结构的重要因子[25], 其很大程度上影响了浮游植物光合作用固定下来碳的流向。它们一方面作为浮游植物的摄食者, 通过选择性摄食影响浮游植物生物量和群落结构[26], 另一方面通过摄食打包、垂直移动和自身新陈代谢等直接影响POC输出通量的大小。在浮游动物群落结构中, 一般认为, 异养鞭毛虫是细菌的主要摄食者, 以纤毛虫和异养甲藻为代表的微型浮游动物主要对鞭毛虫和小粒级浮游植物进行摄食, 而以桡足类为代表的中型浮游动物主要摄食硅藻等大粒级浮游植物和微型浮游动物[27]。营养级别越高, 浮游动物越表现出对食物的选择性。如桡足类对浮游植物群落的选择性摄食主要被认为由形态学和行为学特征所决定, 如口器形态和体长往往是导致不同种类的桡足类对不同藻类的摄食偏好[28]。Liu等[29]发现在香港近岸水域, 即便甲藻在水体中浓度很低, 中型浮游动物也偏向摄食甲藻。在浮游植物群落的不同演替阶段, 桡足类对不同的浮游植物的选择性摄食也不同, 从而能够影响浮游植物生物量和优势种的演替。有研究表明, 在硅藻藻华前后, 桡足类主要摄食甲藻, 而在藻华发生期间则主要摄食硅藻[30]。而且桡足类对微型浮游动物的摄食会影响微型浮游动物对藻华的控制作用, 如纤毛虫以球形棕囊藻(Phaeocystis globosa)为食, 桡足类对纤毛虫的摄食影响了微型浮游动物对棕囊藻藻华的控制[31]。硅藻的硅质细胞壁难以食用, 大多数纤毛虫和轮虫对硅藻具有避食性, 因此在以轮虫为优势的河口区, 往往容易发生硅藻藻华[32], 而某些较大型的异养甲藻(如Gyrodinium)则会对硅藻优先摄食, 某些情况下控制了硅藻藻华的发生[33]。这些特征表现了食物网内部碳流结构的复杂性。
关于浮游动物在POC输出过程中是否扮演主导作用, 目前仍存在一定的争议。例如美国Scripps海洋研究所的Landry教授研究组[34, 35, 36, 37, 38]发表了一系列的研究成果, 表明不论是高生产力海区(如加尼福尼亚上升流)还是低生产力海区(如夏威夷, 赤道太平洋), 浮游动物特别是中型浮游动物产生的碎屑均对POC输出起到了主控作用。Stukel等[36]通过从加尼福尼亚上升流到贫营养盐海区现场比对研究发现, 以浮游动物碎屑为指标的碳流过程e-ratio和经典的有机碳输出指标(ThE-ratio, 用核素234Th示踪的POC输出与初级生产力的比值)存在非常好的一致性。应用上述海区调查数据, 通过2种不同方法的逆生态模型估算获得的POC输出通量也表明其主要受控于中型浮游动物碎屑[37, 39]。尽管浮游动物粪便在沉降过程中被微生物分解或者被食粪动物重新打包, 它们仍然被认为是生源要素沉降的主要载体[40~42]。以浮游动物摄食为中介, 类似细菌、微微型浮游植物等难以直接沉降、易被分解的组分才能够更加有效地被输出到海底。Stukel等[37]通过赤道太平洋现场调查数据的模型分析发现, 聚球藻等微微型生物虽然很难直接输出到真光层之外, 但是通过被微型浮游动物的摄食, 其对POC输出的贡献与其对初级生产的贡献是相当的, 他们的研究成果也展示了分别以聚球藻和硅藻为优势类群的浮游生态系统碳的流动和输出模式。但是, Wilson等[43]报道了东北太平洋通过时间序列沉积物捕获器采集的15年数据显示, 浮游动物粪便对POC输出通量的贡献存在明显的季节变化(变化区间3%~48%)。Gonzá lez等[44]在智利上升流区时间连续观测站的研究发现, 垂直碳输出和硅藻以及粪便之间存在负相关关系。事实上, 不同的食物类型会导致粪便性质的不同, 包括影响它的大小、密度和沉降速率[40, 45]。已有研究结果也显示浮游动物对硅藻摄食会产生更多的粪便[46], 而且这些粪便比摄食其他食物产生的粪便沉降更快[45]。Dagg等[47]报道在北冰洋的锋面区域, 硅藻春季藻华过程中粪便对POC和生物硅的输出贡献比夏季显著增加。Goldthwait等[48]报道了在中尺度气旋涡和模态涡旋中, 中型浮游动物的生物量和粪便都增加。
除了粪便、尸体等碎屑直接影响POC输出通量, 中型浮游动物的主动运输(即垂直移动)也可能对POC输出过程产生重要影响。约有一半的中型浮游动物具有昼夜垂直迁移特性, 在夜晚上浮到海洋表层进行摄食, 而白天回到深层进行代谢作用, 直接将表层POC以CO2或溶解有机碳的形式释放到深层[49]。有研究显示, 中型浮游动物的昼夜垂直迁移对总POC输出的贡献大约在5%~34% [50]。中型浮游动物的昼夜垂直迁移对POC输出的贡献与浮游动物种类组成以及海域和季节相关[40, 41]。
值得一提的是, 翼足类(Pteropods)和浮游被囊类(Tunicata)在生物泵碳输出过程中起着重要和非常独特的作用。翼足类属于终生浮游软体动物, 它和浮游被囊类都是海洋浮游动物的主要类群, 也是胶质浮游动物的重要成员, 在大洋中占有较大的比重[51]。翼足类和浮游被囊类可以有效摄食微微型浮游生物[52], 是微微型浮游生物网(picoplankton food web)的主要途径[53]。翼足类被称为通量摄食者(flux feeder), 可通过体外球状或漏斗状粘液网捕获饵料生物和沉降颗粒, 而后集成粘液条, 摄入口中; 而未被摄食的粘液条则形成假粪(pseudofeces), 随粪便排出体外。浮游被囊类(包括有尾类和海樽类等)是滤食性动物, 其被囊或住屋(house)是滤食器官的重要组成部分。有尾类的住屋可起到过滤大的颗粒、收集小的饵料颗粒的作用; 一旦住屋被堵塞, 有尾类便重新分泌出新的住屋; 而被抛弃的住屋含有大量未被摄食的大颗粒和粪便, 成为海水中有机碎屑的重要组成部分, 对海洋碳垂直通量形成较大的贡献[54]。翼足类和浮游被囊类具有较高的摄食率, 其对浮游植物的摄食压力在某些海域甚至超过其他浮游动物。如在南大洋, 翼足类对初级生产力的摄食压力超过40%[55], 而汤氏纽鳃樽(Salpa thompsoni)对初级生产力的摄食压力达3%~261%, 超过南极磷虾(0.1%~84.5%)[56]。这些浮游动物的假粪、遗弃的粘液网和住屋是浮游动物(如桡足类)的食物, 同时具有很高的沉降速率, 是碳从海洋表层向海底输送的主要途径。据研究, 纽海撙和翼足类的粪便沉降速率分别可达2 700和1 800 m/d, 远远超过其他浮游动物和海洋碎屑[40, 41]。沉积物捕集器数据表明, 在阿拉斯加Papa海洋站, 翼足类产生的POC通量为该海区的POC年通量的49%[57]。因此, 不同海区不同时间浮游动物在浮游生态系统中扮演着不同的角色, 同时也影响着POC输出通量和生物泵效率, 相关的研究在中国边缘海还鲜有报道。
异养细菌是浮游生态系统不可忽视的组成部分。近年来以“ 微食物环” 和“ 微型生物碳泵” 为代表的大量研究成果表明, 各种各样的细菌、古菌和病毒在碳的形态转化和埋藏过程中的作用也是不可忽视的[4, 58]。一方面, 浮游植物在初级生产过程中产生光合溶解有机碳(Photosynthetic Dissolved Organic Carbon, PDOC), 异养细菌的二次生产决定了这些PDOC的去向, 并且能够通过微食物环和浮游动物的摄食产生粪便而沉降, 增加了POC输出通量和生物泵效率。在贫营养海区, 异养细菌的生物量往往等同于甚至高于浮游植物的生物量[59], 因此异养细菌在DOC转换成POC中占据着一个至关重要的地位。另一个方面, 异养细菌和病毒通过分解浮游植物颗粒和浮游动物粪便而降低或溶解这些大型颗粒, 从而降低了浮游植物颗粒沉降速率。研究表明, 在复杂的海洋食物网中, 有机物的生产和再生效率都是很显著的, 这2方面的共同作用决定了有机颗粒的输出通量大小[60], 而微生物(包括自养和异养的)在这个过程中发挥着关键的作用[61]。
如果将浮游生物群落看作一个整体, 根据物质守恒定律, 海洋真光层中POC的变化(
假定海洋真光层处于一个稳态(即
另外, 从海洋生物地球化学循环的角度上看, 海洋碳循环过程还和包括氮、磷、硅、铁等元素在内的其他生物地球化学元素循环过程密切相关[66]。例如, 在东海黑潮区生物固氮过程与浮游植物的初级生产力和新生产力存在非常密切的关系[67]。Smetacek等[68]近期在Nature论文表明, 在南大洋铁限制海区, 铁加富实验不仅改变了浮游植物生物量和类群组成, 也显著增加了POC输出通量。
综上所述, 除海洋生态系统中物理和化学过程的影响外, 碳元素从被浮游植物固定开始到输出真光层的各种生物和生态过程更加复杂。相对于开放大洋, 边缘海的生物地球化学过程更加多变和复杂, 导致浮游生物所处的环境变化更加剧烈, 它们在生物泵过程中扮演的角色也因此难以琢磨。但是JGOFS计划结束后, 特别是在全球碳循环丢失项(missing sink)的问题被提出后, 人们猜测边缘海对大气CO2的源汇作用是碳循环研究中最基础也是最重要的部分, 它的强弱反映边缘海对气候变化的调节能力[2], 也因此希望把陆架边缘海单独列出来和大洋进行对比研究。当前, 在边缘海复杂生态系统中细致地解析这些和生物泵过程密切相关的浮游生物时空演变格局和调控机制, 在生态系统水平上评估它们相互之间及与非生物因子之间的相互作用是了解边缘海生物泵过程, 乃至评估全球碳收支亟需解决的问题。
我国海洋生物泵研究可以追溯到20世纪90年代开展的“ 东海海洋通量联合研究(China-JGOFS计划)” , 之后开展了东、黄海生态系统动力学(China-GLOBEC计划)、台湾海峡生源要素生物地球化学过程研究、南海初级生产过程、浮游植物群落结构、碳的源汇过程与机制等一系列研究。如早在1993— 1994年测定的东海吸收CO2的量为45.5 µ g/( m2· h)[69]。碳在东海陆架的贮存和垂直转移主要的化学组成形式以POC为主, 在表层水体中占总碳的98%以上, 在底层占68%以上[70]。不同时空尺度的生物地球化学过程控制生物地球化学元素通量的大小。如在东海冬季强季风引起的水体交换和混合增加了真光层的营养物质, 促进了初级生产力, 进而引起了POC垂直通量的显著增加[71]。海流引起的颗粒物质的水平运动使表层水体中水平方向的颗粒物质通量不平衡, 表现为同一时期不同深度的沉积物捕获器测量值的差异。如南海浅层捕获器(1 000 m)通量变化范围是11.5~179.7 mg/(m2· d), 而深层捕获器(3 500 m)的测量值范围反而稍微大一些, 达到18.7~168.7 mg/(m2· d)[72]。上述在20世纪末21世纪初开展的研究项目获得了我国边缘海若干海区碳元素海洋生物地球化学行为的重要数据, 奠定了这一多学科交叉领域的基础。相对于物理海洋学和化学海洋学所取得的研究成果, 国内学者对浮游生物系统与重要生源要素(如碳、氮、磷、微量金属等)生物地球化学过程的耦合研究起步较晚。近10年以来, 我国科学家在碳的海洋生物地球化学研究特别是与生物泵相关领域的表现十分活跃。包括基金委在内的资助机构支持了一系列相关研究项目, 取得了可喜进展。
在海洋浮游植物生态学领域, 自2007年Richardson & Jackson在Science上发表了关于微微型浮游植物对碳输出通量具有重要贡献的结果以来[21], 我国海洋生态学研究者重点从浮游植物生物量、生产力和群落结构的时空格局及其与生物泵效率耦合的角度来寻求突破, 期望揭示海洋生物泵结构和功能变动的机理与调控机制。特别是近年来我国学者在西北太平洋边缘海和极地海区针对浮游生物的生物量、群落结构、遗传多样性、生产力以及摄食关系等方面开展了大量研究。例如最近在国家重点基础研究发展计划《中国近海碳收支、调控机理及生态效应研究》的支持下, Guo等[73]和Guo等[74]通过显微镜镜检和流式细胞技术分别报道了东海浮游植物一些重要类群的时空变化。通过中国GLOBEC-IMBER(全球海洋生态系统动力学研究— 海洋生物地球化学和海洋生态系统整合研究)计划的支持, Liu等[75]系统性地研究了南黄海浮游植物群落结构的季节变化, 及其对一些关键生物地球化学过程的响应。这些研究进展进一步加深了我们对东黄海浮游植物时空分布和它们在生态系统中扮演角色的认识。而在南海, 我们通过近十年的大量现场调查也基本摸清了南海北部陆架和海盆区浮游植物群落的时空格局[76~82], 初步分析了浮游植物、浮游动物和细菌等类群之间的相互作用, 及它们与非生物因子间和POC输出通量的关系[83~91]。例如我们的研究结果表明浮游植物生物量和群落结构存在着明显的时空变化, 中尺度物理过程对浮游植物群落结构和POC输出通量有明显影响。不同起源的反气旋涡(暖涡)对浮游植物群落结构影响不同, 黑潮起源的暖涡原绿球藻占优势, 而南海北部局地起源的暖涡则呈定鞭藻占优势[92]。对于起源相同、发展阶段相近的暖涡, 浮游植物生物量和群落结构都不存在显著差别, 但在暖涡的不同空间尺度上却是有差异的[93]。暖涡中心沉降的海水会使暖涡边缘产生亚中尺度的涌升现象, 从而使温、盐和营养盐跃层抬升, 增加了涡旋边缘区真光层内的营养盐通量, 有利于浮游植物生长, 尤其是硅藻和甲藻等适应较高营养盐浓度的类群[94]。而且通过3D环流模型发现涡旋边缘区的水可以通过水平运移至涡旋中心, 而涡旋中心POC输出通量的增大是由边缘高生产力的水经水平传输后所致[93, 94]。此外, 我们通过原位泵分粒级过滤在300 m和500 m发现了聚球藻的特征光合色素(玉米黄素, zeaxanthin)和原绿球藻的特征色素(二乙烯基叶绿素a, divinyl chlorophyll a), 由此得到了南海微微型浮游植物可能会通过聚集、打包作用等, 形成较大颗粒从而提高沉降速率的直接证据 [93]。这和Lomas等[23]在北大西洋马尾藻海获得的结果一致。这些研究结果初步阐明了不同浮游植物功能群在不同生物地球化学过程中与POC输出通量的耦合机制, 也暗示了浮游植物和POC输出的复杂关系[95]。
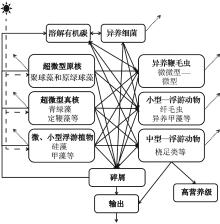
我国海岸线绵长, 以陆架边缘海为主。黄海、东海和南海的自然地理特征迥异, 而且随着我国经济社会飞速发展, 边缘海生态系统受人类活动影响极为突显。因此, 相对于开放大洋, 边缘海生态系统的生物地球化学过程研究意义更加重大, 也颇为困难。在研究实践中, 为了开展生态系统水平的整合研究, 我们一般将浮游生态系统的生物群落分为浮游植物、浮游动物和细菌等少数几个组成部分, 用变动范围很大的经验参考值来表征它们之间的转换速率, 又或者将整个生态系统看成黑箱的形式, 重点关注某些影响因素(如物理过程, 生物量水平或者群落结构等)与生物泵效率(有机碳输出)之间的关系。但是, 基于国内外最新研究进展, 浮游生态系统结构与生物泵效率(功能)之间不是简单的线性关系, 和生物泵POC输出相关的各种过程非常复杂(图1)。例如在南海北部和东海, 我们通过234Th示踪的POC输出通量与积分的初级生产力比值计算生物泵效率(ThE-ratio), 结果显示南海海区和全球其他海区类似, 生物泵效率较低, ThE比值多数都在10%或以下。但是, 浮游植物生物量、生产力和群落结构与POC 输出通量的关系在空间上存在显著差异[95]。例如在南海北部近岸和陆架区, 硅藻是控制POC输出通量的主要因素, 高硅藻比例高POC 输出通量; 而在海盆区, 小粒级浮游植物(定鞭藻8型和青绿藻等)在生物泵过程中扮演的角色可能更为重要[93, 95]。在南海海盆区, ThE-ratio与聚球藻和原绿球藻所占比例之和呈现显著的正相关(p< 0.001), 暗示微微型浮游植物的无论在初级生产力、POC输出通量、沉降效率还是生物泵效率上都体现出非常大的重要性[93]。另外, 如前文所述除了浮游植物的因素外, 浮游动物的摄食、同化、排泄甚至垂直移动都和生物泵效率密切有关, 细菌和病毒等微生物的作用同样也不可忽视, 因此, 了解整个浮游生态系统群落结构和构建碳流过程模式对于揭示生物泵的控制机制十分重要。目前, 哪些过程和因子在边缘海生物泵过程中扮演关键角色仍不清楚。关键科学问题可以总结为:边缘海浮游生物群落如何调控生物泵效率?这一科学问题可以进一步分解为如下两个问题:其一是边缘海不同生态系统浮游生物群落(功能群)结构对生物泵效率的调控:即边缘海不同生态系统(如河口、上升流、陆架和海盆生态系统)浮游生物群落组成与结构差异, 及其与POC输出通量的关系, 物理– 化学过程的影响如何?其二是边缘海浮游生态系统的碳流过程模式及其对生物泵效率的调控:即边缘海不同生态系统的低营养级碳流模式的差异, 哪些是影响POC输出通量的关键过程(速率)?
针对存在的问题和国内已有研究基础, 结合近年来国际上浮游生态系统和碳循环研究进展和发展趋势, 我们认为在考虑浮游生物量和组成结构(POC储库)、生产力(POC生产速率)量级的同时, 应该从完整的浮游生态系统碳流的角度出发(图1), 重点对影响POC输出通量的关键生物地球化学过程开展研究。如有机碳的初级生产(浮游植物固碳)、有机碳存储和组成结构(浮游生物不同类群现存生物量)、有机碳传递和再循环(浮游动物摄食和异养细菌二次生产)、有机碳输出(浮游植物沉降和浮游动物排泄)和有机碳的消耗(群落呼吸和细菌呼吸)等。以浮游植物为例, 我们在关注其总生物量和初级生产力的同时, 必须评估不同环境中的优势类群, 定量它们对生物量和生产力的贡献。另外, 还要了解主要浮游植物类群在生长率、沉降速率、呼吸速率、死亡率(包括摄食死亡和自然死亡)及分解速率等方面的差异, 及这些因素对真光层内POC储库和POC输出通量的影响。最终我们通过了解这些关键生物过程的特征参数和变动机理构建不同浮游生态系统(如河口、上升流、陆架和海盆)碳流过程和POC输出模式。
为实现上述目标, 我们认为针对不同的生态系统, 应该从生态系统结构和功能(POC输出)的角度将多种多样的浮游生物归类(如按功能类群), 着重研究那些对POC输出过程产生重要影响的浮游生物重要功能群。关注过程研究, 即在研究生态系统各个组分的有机碳储量和组成的同时, 关注关键生物地球化学元素在它们之间的转换速率。我们亟需找到评估这些过程参数的方法, 确定它们在不同生态系统中的量级以及在不同时空尺度下的变化规律, 解析影响它们时空动态的生物和非生物因子。寻找到合适和准确的方法评估这些速率是当前海洋浮游生态学研究的瓶颈。只有在获得可靠的数据参数的基础上, 才能结合生态模型分析, 探讨到底是哪些物理— 生物地球化学过程对这个生态系统POC的最终输出产生重要影响。
另外, 海洋生物泵及其碳循环研究是一个多学科交叉特色明显的研究领域。除了从生态学角度解析生态系统内部的结构和功能外, 还应该综合物理海洋学、化学海洋学、卫星遥感及数值模型等多个研究手段, 重点开展生态系统内部的机制研究和不同的生态系统的比较研究。例如在陆架、海盆、上升流和冲淡水等典型生态系统, 从基因到生态系统, 有针对性地了解各种时空尺度的物理— 化学— 生物过程; 解析在这些物理、化学背景下浮游生物群落在碳循环中的各种过程及其对生物泵的控制机制; 比较不同生态系统下浮游生态系统结构和碳流过程模式的异同。这样我们才能够进一步阐明复杂边缘海的浮游生态系统对生物泵效率的影响及其调控机制。
与此同时, 在当前全球气候变化和人类活动的大背景下, 我国近海生态系统正面临着富营养化、海洋资源退化、有害赤潮频发、变暖、酸化和缺氧等严峻的多重压力。海洋生物泵过程研究应考虑在复杂地球系统中耦合气候变化和人类活动带来的多重影响, 有针对性开展研究工作。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
|
| [86] |
|
| [87] |
|
| [88] |
|
| [89] |
|
| [90] |
|
| [91] |
|
| [92] |
|
| [93] |
|
| [94] |
|
| [95] |
|