作者简介:吴曼(1978-),女,河南镇平人,博士,主要从事海洋光化学和溶解有机物研究. E-mail:wman@xmu.edu.cn
海水中过氧化氢(H2O2)能与多种痕量金属发生氧化还原反应并改变其存在状态,从而间接影响海洋生态系统。综述了过去30多年的研究结果并提出进一步研究方向。H2O2在100~200 m以浅的上层海洋中普遍存在,浓度介于0~102 nmol/L之间。H2O2在表层含量最高,随深度增加而减小;近岸海区H2O2浓度通常高于寡营养大洋;并且海水中H2O2出现典型的周日波动(白天浓度增加,于午后达到最大值后逐渐降低,至黎明达到最低值)。海水中H2O2的来源包括光化学生产、大气沉降和生物生产,一般以光化学生产为主。去除过程包括生物分解、光化学分解和化学分解,以生物分解为主。目前对H2O2在受河流影响的近岸陆架海区中的生物地球化学、光化学生产的影响因素以及H2O2的去除机制尚缺乏全面认识,在这些方面还需更多研究。
Hydrogen peroxide can oxidize or reduce a number of biological important trance metals in seawater. Therefore, it can indirectly affect the marine ecosystem by causing the changes in the speciation of these metals. The results of researches about hydrogen peroxide in seawater in the last more than thirty years were reviewed and the direction of study in the further was proposed in this paper. Hydrogen peroxide can be found rather ubiquitously in the upper water at concentration of 0~102 nmol/L. In water column the maximum of the concentrations of hydrogen peroxide presents in surface water and the concentrations decrease with the increase of depth. In general, the concentrations in costal seawater are higher than these in the oligotrophic ocean. Diel variation of hydrogen peroxide occurs in seawater: the concentrations increase since sunup until the mixmum of afternoon and decrease until the minimum at drawn. The sources of hydrogen peroxide in marine environment include photochemical production, atmospheric deposition and biological production, and the photochemical production is primary among them. The sinks of hydrogen peroxide in the ocean consist of biological and chemical and photochemical decomposition and the main one is biological decomposition. The biogeochemistry of hydrogen peroxide in the continental shelf influenced by river water and factors affecting photochemical production and detail of decomposition should be studied in the future.
现有研究表明,上层海洋普遍含有过氧化氢(H2O2),浓度可高达102nmol/L[ 1, 2, 3]。在海水的弱碱性环境中H2O2既具有氧化性也具有还原性,对海洋的化学和生态环境具有重要的影响。海水中H2O2与多种痕量金属发生氧化还原反应,如铁[ 4, 5, 6, 7, 8]、铜[ 9, 10]、铬[ 11, 12]、砷[ 13]和锰[ 14],从而改变了这些金属在海水中的存在形态,影响到它们的生物可利用性和(或)毒性[ 15],从而间接影响海洋生态系统[ 3, 16]。Willey等[ 17] 在大西洋百幕大时间序列站(Bermuda Atlantic Time Series Station, BATS)进行的模拟降雨生物实验表明,雨水带入的H2O2将Fe2+氧化为Fe(OH)3,导致溶解铁浓度降低,从而抑制了铁对海水生产力的促进作用。另外高浓度的H2O2也会破坏细胞膜并导致叶绿素诱变和白化,直接影响浮游生物的生长[ 16]。目前引起广泛关注的全球环境问题——珊瑚礁退化中,H2O2及其他活性还原氧所造成的氧化压力就是引起该问题的原因之一[ 18, 19]。
海洋H2O2的研究始于20世纪60年代。Van Baalen等[ 20] 于1966年首次报道了在墨西哥湾的Aransas港附近的海水中存在102nmol/L 的H2O2,并预言它可能对海洋生态系统有重要影响。20世纪80年代以来,相继有不同学者研究了H2O2的分布特征及其来源和去除过程。
海水中H2O2的测量方法有以下三种:荧光法、化学发光法和分光光度法[ 21]。其中荧光法最为常用,在过氧化物酶催化下H2O2将加入水样的荧光试剂氧化,导致反应前后溶液荧光强度改变,荧光强度的变化量与水样中H2O2浓度呈正相关关系。最常用的荧光试剂是6-甲氧基-7-羟基香豆素(scopoletin)[ 22, 23, 24, 25, 26, 27, 28, 29]和对羟基苯乙酸(p-hydroxy phenylacetic acid, 简称POHPAA)。scopoletin本身具有荧光活性,被H2O2氧化后失去荧光活性[ 3, 30, 31, 32],而POHPAA本身不具有荧光活性,被氧化后形成具有荧光活性的二聚体。另外也有研究者使用本身没有荧光活性的对羟基苯丙酸(p-hydroxy phenylpropionic acid)作为荧光试剂测量海水H2O2浓度,它被氧化后也形成具有荧光活性的二聚体[ 33]。荧光法的检测限一般在2~5 nmol/L范围内,标准偏差通常小于5%。化学发光法也被广泛应用,在钴(Ⅱ)催化下H2O2与鲁米诺试剂反应产生激发态的3-氨基-邻苯二甲酸盐,该激发态盐释放光子回到基态过程中发射的光子数量与水样中H2O2含量正相关[ 34, 35, 36, 37, 38, 39, 40]。Yuan等[ 41]对化学发光法测量条件优化后,其检测限可低至0.42 nmol,精密度为2%~3%。近来也有研究者使用吖啶酯作为化学发光试剂测量海水中H2O2浓度取得成功,检测限5nM,精密度为4%[ 42]。相对其他2种方法而言,分光光度法应用相对较少,该方法基于酶调节下H2O2氧化显色试剂形成有色物质的反应。Johnson等[ 43] 采用N-乙基-N-(磺丙基)苯胺(N-ethyl-(sulopropyl) analine, 简称ALPS)和4-氨基安替比林(4-aminoantipyrene)为显色剂,检测限为12 nmol,Bader等[ 44]采用N,N-二乙基-对苯二胺作为显色剂,检测限为9 nmol。分光光度法的检测限较荧光法和化学发光法高,使它在寡营养大洋海区的应用受限。最近Olasehinde等[ 45]利用芬顿(Fenton)反应测量海水中H2O2浓度,酸性条件下H2O2被Fe(Ⅱ)还原生成羟基自由基(OH• ),OH•与苯反应产生苯酚,通过反相高效液相色谱分离出苯酚,用荧光法测量苯酚含量来定量水样中H2O2含量,该方法的检测限为4 nmol,精密度为1.9%~2.4%。流动注射系统在上述3种H2O2测量方法中均普遍使用,可用于表层海水H2O2走航观测,在单个样品分析时也使分析测定更快速、重现性更好,操作更便利。因为过氧化物酶催化剂可以被H2O2和有机过氧化物氧化,凡是基于过氧化物酶催化反应的荧光法和分光光度法实际上测量的是水样中H2O2和有机过氧化物的总量,但Miller等[ 21]的研究表明海水中有机过氧化物含量很少,并不影响这些方法的使用。
由于H2O2的不稳定性,水样的保存非常关键。海水受光照时可以通过光化学反应产生H2O2,所以采集后一定要避光保存,即使黑暗下依然有H2O2生产和分解过程,因此一般要求水样采集后1~2小时内分析完毕。Zhang 等[ 3]采用scopoletin荧光法测量H2O2浓度时,水样加入荧光和酶试剂后在室温黑暗条件下保存,4天内测量荧光强度,分析结果不受影响。作者采用他们的分析步骤进行的样品保存实验表明加入试剂的水样在室温黑暗条件下最长可保存6天,若在4℃黑暗条件下30天内测量荧光强度,结果不受影响。
已有研究普遍发现,海洋中H2O2垂直分布大体上呈现随深度增加浓度逐渐降低的趋势,100~200 m处减小到低于一般测量方法的检测限(5 nmol/L)[ 22, 23, 28, 34, 46, 47]。这是由于水体中H2O2主要来源于光化学生产,光强在水柱中衰减所致[ 2]。但是H2O2浓度随水深的减小速率并不像光强在水柱中衰减那么快,水体的垂直混合作用使表层光照产生的高浓度H2O2被传输到下层水体削弱了H2O2在水柱中随深度而减小的趋势[ 48],因而H2O2的垂直剖面往往也与水体垂直混合状态密切相关。
常见的海洋H2O2垂直剖面可以分为3种类型。第一种,上混合层内H2O2浓度基本不变化,混合层之下的密度跃层内随深度增加而迅速减小。Moore等[ 23]在加勒比海东部、Zika等[ 22]在墨西哥湾、Yuan等[ 34, 37]在大西洋南部和西北太平洋、Steigenberger等[ 38]在大西洋东部都观测到这种垂直剖面。这是由于上混合层在短期(几小时)内经历过混合过程。第二种,H2O2浓度在上层水柱中均随深度增加而减小,即使在混合层内H2O2浓度依然随深度增加而减小。Yuan等[ 34]在大西洋南部、Zika等[ 47]在秘鲁上升流海区、Avery 等[ 28]在BATS均发现此类特征的H2O2垂直剖面。第三种,表层H2O2浓度很高,但随水深迅速减小到低于方法检测限,常见于受河流输入影响的海区,如加勒比海东部受河水影响的水体[ 23]、亚马逊河口附近海区[ 34]。这主要是由于表层冲淡水含有高浓度吸光有机物导致H2O2的大量生产,同时表层的高浓度吸光有机物起到类似滤光片的作用,阻挡阳光进入水体,致使下层水体中H2O2光化学生产速率迅速减弱。另外,由于垂直混合较弱,上层高浓度的H2O2不能混合进入下层水体。
但Johnson等[ 48]、Szymczak等[ 49]、Yuan等[ 34]和Avery等[ 28]均在近岸海水或者大洋的个别站位观测到异常的垂直剖面,即在次表层水体出现显著的H2O2极大值。水团迁移及锋面过程是造成某些站位次表层水体H2O2极大值的原因,但另有一些站位H2O2的异常垂直分布的确切原因尚未知,可能由水柱内某些未知的H2O2生产过程造成。最近作者在南海北部外部陆架和陆坡区也观测到异常的H2O2垂直剖面,上层100 m水柱内H2O2浓度均高于周围水体,最大值出现在70~80 m水体。同步调查显示该海区有强烈的内波活动,同时这些次表层水体中细菌活性较周围水体显著增高,尽管产生这些高值的具体原因未知,但内波引起的物理混合和细菌生产很可能对这里的H2O2高值有重要贡献。
表1总结了不同海区表层海水H2O2浓度。总体而言,开阔大洋表层H2O2浓度通常较低,一般低于100 nmol/L,近岸海区及河口表层水中H2O2浓度通常较开阔大洋高,一般高于100 nmol/L。在大洋区测得的少量站位较高的H2O2浓度通常来源于降雨输入[ 28, 35, 46]。秘鲁沿岸海区表层含有较低的H2O2浓度是由于上升流将H2O2含量低的深层水带入表层所致[ 47]。DOM是光化学产生H2O2的重要前提物质,近岸海区通常初级生产力和DOM含量较大洋高,因而H2O2浓度也高。也有研究表明在大尺度范围内,表层H2O2浓度存在纬度变化[ 34, 37, 38, 50]。这种纬度差异与太阳光强度、温度、湿沉降、混合层厚度等因素有关。
| 表1 不同海区表层水H2O2浓度 Table 1 The concentration of H2O2 in surface seawater |
众多现场调查发现,海水中H2O2含量通常有明显的周日变化特征:白天H2O2浓度逐渐增加,一般于午后达到最大然后逐渐降低,至黎明达到最低值后再逐渐升高[ 22, 28, 34, 46, 47](图1)。已有研究报道的周日变化幅度一般在20~100nmol/L范围内,受水体中DOM含量、阳光强度、生物活动等因素的影响。然而,当光化学生产不是水体中H2O2的主要来源时,水体H2O2浓度便不再呈现这种典型的周日变化。如Avery 等[ 28]在大西洋、Yuan等[ 37]在西北太平洋的调查中均发现H2O2含量无周日变化,光化学生产不是调控这些海区表层H2O2的主要因素,H2O2的其他来源(如生物生产和降雨)起主要作用。另外降雨也可引起表层海水H2O2浓度在几天之内的短期变化甚至显著的季节变化[ 24, 46, 51]。
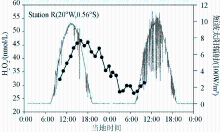 | 图1 赤道大西洋H2O2和阳光短波辐射日变化[ 34] ●:H2O2,—:短波太阳辐照强度(右侧坐标轴)Fig. 1 Diurnal variations of the concentration of H2O2 and solar irradiance ●:H2O2,—:short wave solar radiation (right axis) |
3.1.1 光化学生产
早在20世纪80年代,科学家已经发现各种天然水体中H2O2浓度在阳光照射下逐渐增加,并且增加的速率与水体中吸光DOM含量呈正相关关系,表明与有机物相关的光化学过程是天然水体中H2O2的来源。同时对海洋中H2O2的现场调查也表明H2O2的垂直分布、水平分布及周日变化规律也反映出光化学生产对海洋H2O2的分布的重要控制作用[ 29, 30, 31]。
表层海水中吸光有机物中苯酚的光离子化产生水合电子,水合电子对氧有高度活性,与氧反应后生成过氧化物阴离子游离基O2-,O2-既可作为氧化剂也可作为还原剂与各种有机物或金属离子反应,当活性底物的数量不足时迅速发生歧化反应生成H2O2或其他过氧化物[ 55]。根据目前已经观察到的事实,H2O2的光化学生产机制可总结如下:
CDOM+ hv→CDOM* (1)
CDOM*→ (CDOM+ + e-)* (2)
(CDOM+ + e-)*+ O2 →CDOM+ + O2- (3)
2O2- + 2H+ → H2O2 + O2 (4)
O2-+ Men+⇋ {MeO2}(n-1)+ H+→ Me(n+1) + HOOH (5)
O2- + Org(red) + H+ → Org(ox) + HOOH (6)
基于上述H2O2的光化学生产机理,水体中H2O2的光化学生产与DOM密切相关。许多研究表明H2O2光化学生产速率与DOC或有色溶解有机物(CDOM)含量之间有显著正相关关系[ 23, 56, 57, 58]。另外水体中不同DOC组分通过光照产生H2O2效率可能也不同,Cooper等[ 56]的研究结果暗示了地下水TOC产生H2O2的效率较地表水TOC高;Price等[ 39]的研究表明从Dodder河水中提取的富里酸比腐殖酸和亲水大分子酸以及购买的离子胡敏酸盐光照产生H2O2的效率低50%,地中海西部受Rhône河流冲淡水影响的表层海水中等分子量(300~8000 道尔顿(Da))的DOM比大分子量DOM(>8 000 Da)、和小分子量DOM(<300 Da)产生H2O2的效率高。不过目前对海洋环境中不同DOM组分产生H2O2效率差异的研究还很少。
光谱组成对H2O2光化学生产的影响也早已引起众多关注,研究结果表明各种水体的H2O2表观量子产率(apparent quantum yield,AQY,即1 mol某一特定波长的光子被吸收后产生H2O2的物质的量)均随波长增加而减小,表明对各种水体而言所吸收的短波光产生H2O2的效率均较长波光更高[ 2, 23, 57, 58, 59, 60, 61]。但不同水体AQY随波长的减小速率存在差异,暗示不同水体中DOM组成差异的影响。不过这些研究大部分聚焦在紫外光区,仅有少量研究包含紫外光和可见光[ 57, 61],结果表明紫外光和可见光都能引起H2O2光化学生产,但紫外光起主要作用。
Scymczak等[ 53] 和Yocis等[ 2]的研究表明水体温度对H2O2光化学生产速率有影响,Port Hacking河口水H2O2光化学生产速率从5 ℃的12 nmol/( L· h)增加到45 ℃的102 nmol/(L· h),且光化学生产速率随温度的增加符合阿伦尼乌斯规律经验式,而南极水体温度每降低1 ℃,H2O2光化学生产速率降低0.2 n mol/h,作者对南海水的研究结果表明5~30 ℃范围内,温度每升高10 ℃南海北部表层海水H2O2光化学生产速率约增加1倍。
寡营养的大洋水体H2O2光化学生产速率较低,一般小于10 nmol/(L·h) ,如亚热带大西洋[ 62]、大西洋百慕大时间序列站(Bermuda Atlantic Time Series Station, BATS)[ 28]、大西洋中南部[ 34]、西北太平洋[ 37]和南极海区[ 2]的H2O2光化学生产速率分别为5.5,6.6 ,8.3,8,和4.5 nmol/(L·h)。而在近岸海区DOM含量一般较高,导致光化学生产速率通常显著高于大洋,Port Hacking河口[ 53]和Rhnôe 羽状流[ 39]的H2O2的光化学生产初始速率分别为18和67 nmol/(L· h),加勒比海东部近岸受河流影响的某些站位甚至高达547 nmol /(L·h)[ 23]。
3.1.2 生物生产
已有报道发现,生物可通过胞外酶的作用利用氨基酸的过程中产生H2O2[ 63, 64],在光照条件下的浮游植物光合生产H2O2过程也有报道[ 65, 66, 67],但目前还没有在海洋环境中测量到H2O2光合生物生产速率。一般研究者将黑暗条件下测量到的H2O2增加归于生物生产,Moffett等[ 68]测得Vineyard Sound近岸海域的表层水样在黑暗条件下H2O2的生产速率为0.8~2.4 nmol/h;Palenik等[ 69]报道一种钙化海洋浮游植物Hymenomonas carterae在培养液中黑暗条件下H2O2的生产速率为1×10-14~2×10-14 mol/(cell.h)。然而,目前对天然海水中H2O2生物生产的研究还很少,仅Palenik等[ 33]测量了马尾藻海不同深度的海水在黑暗条件下的生产速率,结果表明40~60 m次表层海水中H2O2的初始生产速率可达11 nmol/h,在8.5 h的整个培养周期中平均生产速率达1~3 nmol/h。这样的生产速率相对于近岸海区表层水中H2O2光化学生产速率而言确实不高,但是与开阔大洋表层水H2O2光化学生产速率接近,因此生物生产过程也可能成为开阔大洋区H2O2的重要来源[ 37]。
3.1.3 大气沉降
雨水中H2O2的浓度比海水高2~3个数量级,因此一次降雨事件能使海表面H2O2浓度剧增,甚至令表层海洋H2O2浓度增加超过10倍[ 17, 24, 26, 51, 70, 71]。但是由于降雨的短暂性,输入的H2O2很快就分解减少,数天后H2O2浓度即恢复到原来水平[ 34, 46]。不过,在某些特定海区 (如热带辐合区、太平洋辐合区及温带多雨区) 较高的湿沉降量可能会导致该海区上层水体中H2O2储量增加,目前已发现中纬度太平洋、中纬度大西洋以及热带辐合区存在较高的H2O2储量,这很可能就是来自湿沉降的H2O2输入[ 35, 37, 38]。大气中以气态H2O2形式向海洋迁移的干沉降通量远小于湿沉降和水体中H2O2的光化学生产,并不是海洋H2O2的重要来源[ 2, 26, 72]。
由于光照下海水中会通过光化学过程产生大量H2O2,为研究海水中H2O2的去除过程许多研究者观测了天然海水水样在黑暗情况下H2O2含量的变化[ 1, 23, 28, 34, 53, 73],这些研究结果均表明避光情况下天然水体中H2O2逐渐衰减,衰减曲线符合与H2O2浓度相关的一级反应特征,海水中H2O2半衰期在几个小时到几天的时间尺度内,一般近岸水体半衰期较大洋水短。对天然水样的过滤预处理会大大减小H2O2的衰减速率,而灭菌预处理甚至会阻止H2O2衰减,这些结果表明水体中生物应该是分解天然海水中H2O2的主体力量。
目前对海水中H2O2的各种去除机制研究还很少。目前大多数研究者认为可能的去除机制包括:生物分解、光化学分解和化学分解[ 16]。上述多位研究者进行的黑暗下H2O2衰减实验及Moffett等[ 68]进行的同位素标记研究均表明生物分解为主要机制。由于H2O2对生物的毒性,生物体细胞内含有过氧化物酶(catalase)、过氧化物酶(peroxidase)及过氧化物歧化酶(superoxide dismutase)来减少细胞内过量的H2O2[ 1]。Petasn[ 1]将多种培养的微生物加入湾流海水中研究海洋微生物对H2O2分解的影响,结果表明在生物调节下H2O2分解过程与H2O2浓度和生物量分别呈现一级反应的相关关系。其中细菌(弧菌 Vibrio Pelagius)和一种蓝细菌( Synechococcus sp.)能显著调节H2O2分解,反应的速率常数分别为8.81×10-11/cell /h和3.51×10-10/cell/h;而真核海洋浮游植物 Thoracosphaera heimii和 Gephyracapsa oceanica分解H2O2的能力十分有限, Emiliana huxleyi、Streptotheca tamensis和 Micromonas pusilla对海水中H2O2分解的影响更小。Wong等[ 16]研究了各种海水环境中常见的9种浮游植物分解H2O2能力,表明这些浮游植物在黑暗条件下都能分解H2O2,分解速率常数在2×10-4~2.7*10-2 /μg chl -a / h-1范围内,其中蓝细菌 synechococcu sp.和硅藻 Sketetonama costatum分解H2O2能力最强,而定鞭金藻 Pleurochrysis carterae和绿藻 Dunaliella tertiolecta的分解能力最弱,其他五种浮游植物(包括硅藻 Chaetoceros simplex和 Thalassiosira oceanic、定鞭金藻 Isochrysis galbana、绿藻 Tetraselmis sp.和 Punaliella tertiolecta以及双鞭毛藻 Amphid inium carterae的分解能力处于中等。海水中H2O2的光化学分解过程在上述黑暗条件下的研究难以体现,Moffett等[ 68]利用同位素标记技术观测到了海水中H2O2氧化为O2, 他们对东加勒比海表层水的研究表明H2O2光化学分解在各个站位普遍存在,分解速率与H2O2光化学生产速率成正比,也与水样在300nm的吸收强度线性相关,但是分解速率仅占H2O2光化学生产的5%,表明光化学分解并不是主要机制[ 74]。已有研究表明H2O2可与过渡族金属及有机成分发生反应,因此海水中H2O2化学分解机制很可能存在,但是目前尚未对该过程进行过定量研究,不过由于海水中过渡族金属含量很低,金属调节的分解可能可以忽略[ 1]。化学分解可能在所有分解途径中最微弱,但不可排除这种分解机制。
H2O2作为氧化还原活性物质,对海水中许多有氧化还原活性的痕量物质的存在状态有重要影响,同时也间接和直接影响海洋生态系统。另外高浓度的H2O2也对海洋生物有负面影响,对珊瑚礁系统的破坏目前受到广泛关注。近30年来的研究已取得许多有意义的成果:
首先,对H2O2的时空分布有明确认识。上次海洋普遍含有0~102 nmol/L的H2O2,随深度增加H2O2浓度逐渐减小,至真光层100~200 m处减小到低于一般测量方法的检测限(5 nmol/ L)。水平分布上,H2O2浓度与水体中有机物含量密切相关,近岸海区一般高于远洋。海水中H2O2含量通常有显著的周日变化,其含量随光照强度增加而增加,一般午后达到最高值后逐渐降低至日出前达到最低值。光化学生产是控制H2O2时空分布的主要因素,另外降雨对局部海区的H2O2的影响也不容忽视。
其次,对海洋H2O2的源汇过程有初步认识。与有机物相关的光化学过程是海洋中H2O2的主要来源,另外生物生产和湿沉降也有一定贡献。生物分解是海洋H2O2的主要去除途径,光化学分解和化学分解可能也是海洋H2O2的去除途径,但就目前所知这二者对H2O2去除的贡献很小。
但还有以下方面值得进一步研究:
(1)H2O2在河口及受河流影响的近岸海区的分布及其对海洋化学和生物环境的影响还需进一步研究。因为该海区含有大量的陆源有机物,并且河流带来的高浓度营养物质也导致该海区生产力较高而产生大量海源有机物,这些高浓度的有机物在光照下可能产生高浓度的H2O2,例如受河流影响的东加勒比海H2O2浓度高达500 nmol以上[ 27]。但是目前对这类海区H2O2的研究还很少。
(2)对影响海洋H2O2光化学生产的因素,尤其是有机物的含量和组成、水温,阳光组成和强度对其的影响尚待深入探索,因为光化学生产通常是控制H2O2时空分布的重要过程。另外H2O2的生物生产和去除过程对我们了解H2O2的时空分布也非常重要,例如目前在一些海区发现的次表层H2O2极值令人费解,光化学生产和湿沉降过程都不能解释这种现象,当没有明显的证据表明是水体运移过程造成时,生物过程有可能是主要原因,但我们目前对此了解还十分有限,难以解决此类问题。
(3)海水中H2O2的去除过程对其分布和停留时间也有重要影响,但是目前对H2O2的具体去除机制的分析和定量还缺乏充分认识,还需更多研究工作。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|


