刘春颖(1972-),女,上海人,副教授,主要从事海洋化学研究.E-mail:roseliu@ouc.edu.cn
海水中主要含硫化合物β-二甲基巯基丙酸内盐(DMSP)降解可产生丙烯酸(AA)和活性气体二甲基硫(DMS)。2011年8月对黄海冷水团海域的AA及相关参量的分布特征进行了研究。结果表明,该海域表层海水中AA的浓度为0~0.208 μmol /L,平均值为(0.081±0.075) μmol/ L。AA的高值区出现在海域的东南部,可能是受到长江冲淡水的影响。AA的浓度总体上呈现出由南到北递增的趋势,与Chl-a较为一致,表明该海域的AA主要是由DMSP裂解产生的。表层海水中AA与温度表现出明显的负相关性。AA的垂直分布表现为:中层>底层>表层,这可能是产生AA的浮游植物与消耗AA的细菌共同作用的结果。海域中AA浓度与DMSP或DMS无明显的相关性。AA浓度远高于DMS,AA/DMS平均为106∶ 1,初步估算出DMSP降解产生的AA约为66.5%。AA/Chl-a平均为126.6 mmol/g,比DMSP/Chl-a高1个数量级,比DMS/Chl-a高2个数量级。
Acrylic acid (AA), together with the major biogenic sulfur compound dimethylsulfide (DMS), is microbially degraded from dimethylsulphoniopropionate (DMSP), which is one of the major sulfur compounds in the marine environment. Distributions of AA concentrations and related parameters in the Yellow Sea Cold Water Mass was studied during August, 2011. The results showed that the concentrations of AA ranged from 0 to 0.208 μmol/L in the surface water, with an average of (0.081±0.075) μmol/L. The high values appeared in the southeast part of this area, which was influenced by the Changjiang diluted water. An increasing trend from the north to the south of AA concentrations was basically consistent with that of chlorophyll a (Chl-a), suggesting that AA in this area was mainly the product of microbial cleavage of DMSP. There was a significant negative relationship between AA concentrations and temperature in the surface water. The vertical profile of AA concentrations were presented as follows: Middle>Bottom>Surface,which could be attributed to the combined effects of AA production from phytoplankton and AA consumption by aquatic bacteria. Concentrations of AA showed no obvious correlation with those of DMSP or DMS during this cruise, and they were far higher than concentrations of DMS. The average ratio of AA/DMS was 106∶ 1, and production of AA from the cleavage of DMSP was about 66.5% according to observed data. The average ratio of AA/Chl-a was found to be 126.6 mmol/g. It was one order of magnitude higher than that of DMSP/Chl-a and two orders of magnitude higher than that of DMS/Chl-a.
除陆源输入外,海水中的丙烯酸(Acrylic Acid, AA)是海洋主要含硫化合物β-二甲基巯基丙酸内盐 (Dimethylsulfoniopropionate, DMSP)裂解的产物之一[ 1~ 6]。AA是海洋中细菌的重要碳源,在生态系统中具有广泛的抗菌性,也可作为浮游植物的活性防御因子起到抑制捕食的作用,但高浓度的AA对水生生物有毒害作用[ 7~ 12]。AA和二甲基硫(Dimethylsulfide,DMS)由DMSP裂解后等摩尔产生,目前对DMS的研究已经取得了重大进展[ 13~ 16],然而对AA的产生、分布和转化过程所知甚少。因此开展海水中AA的来源、分布与迁移转化研究,有助于认识海洋硫循环过程,了解AA在海洋硫循环和碳循环中的地位与作用,同时具有重要的生态学意义。
黄海冷水团,亦称黄海中央水团,位于黄海中部洼地的深层和底部,只显现于夏半年。其主要特征是显著低温(4.6~9.3 ℃),是由冬季进入黄海的外海水与沿岸水混合而成,并因海面的冷却作用而下沉到深底层,冬季呈垂直均匀状态。夏半年,上层水因增温降盐而层化,下层水仍保持其低温高盐特性,因而形成冷水团,成为黄海夏季的重要水文特征。7~8月,冷水团达鼎盛期,9月以后,随垂直混合逐渐加深而消失[ 17, 18]。由于黄海冷水团水域(也称冷水域)被陆地三面包围,海区内生产力水平比较高,是研究海洋生态环境受人为活动影响较为理想的海域。
本文通过对黄海冷水团水域这一代表性海域的调查,探讨了AA和相关产物的分布特征、影响因素及DMSP的降解状况。
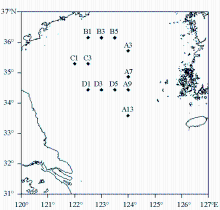
2011年8月15~25日乘“东方红2号”船,对黄海冷水团水域进行了调查采样,具体站位如图1所示,包括12个站位,其中对A系列站位进行了垂直分布的研究。
海水样品由8 L Niskin采水器采集,采样后立即用0.2 μm滤膜重力过滤,4 ℃下冷藏,上岸后在1个月内测完。DMS和DMSP浓度在现场测定。现场海水温度和盐度等参数由Seabird 911+CTD在采集海水时同步测定。
AA的测定:采用Agilent SB-Aq-C18柱,0.35%磷酸溶液为流动相,使用紫外检测器,检测波长为210 nm,外标法用L-2000高效液相色谱(日本日立公司)定量测定。方法的检出限为0.004 μmol /L,精密度为1.6%[ 19]。
DMS和DMSP的测定:将10~20 mL样品用玻璃注射器注入气提室,用40 mL/min的高纯氮气吹扫20 min,经过有无水CaCl2的干燥管干燥后,经液氮冷阱捕集一段时间后,再换热水浴加热解析,最后DMS被载气带入GC-14B气相色谱(日本岛津公司)进行分析。所用方法和仪器的检出限为2.7×10-12 S,精密度为5%。DMSP的测定是在pH≥13的强碱条件下按1∶ 1的比例完全降解为DMS,通过测定DMS含量间接得到DMSP的含量[ 20]。
叶绿素a (Chl-a)的测定:现场取定量海水样品经Whatman GF/F玻璃纤维滤膜过滤后,用铝箔包裹于冰箱内冷冻保存,待返回陆地实验室后,将滤膜以体积分数为90%的丙酮水溶液在暗处萃取24 h,利用F-4500荧光仪(日本Hitach公司)测定其浓度[ 21]。
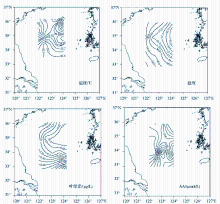
8月黄海冷水团水域的水文特征为,表层水温介于22.2~23.4 ℃之间,平均值为(22.8±0.3)℃,在冷水域的西侧斜坡和东北部出现了2个冷中心。表层盐度的变化范围为30.4~31.9,平均值为31.1±0.5,盐度出现了由西向东逐渐增大的趋势,这可能是受进入大陆架浅海的外海水的影响所致。
对夏季冷水团水域Chl-a的调查结果显示,Chl-a的浓度范围介于0.38~0.95 μg/L之间,平均值为(0.51±0.15) μg/L,其中最大值出现在A13站位,其次是B1站位,最小值出现在A3站位。Chl-a的总体变化趋势表现为:冷水域东北部Chl-a含量最低,冷水域的北部向东南部方向Chl-a逐渐增大,同时由冷水域中部向南部亦逐渐增大,并在东南部的A13站位达到最大值。
对夏季黄海冷水域AA的调查结果显示,表层海水中AA的浓度范围为0~0.208 μmol/L,平均值为(0.081±0.075) μmol/L。其中浓度最大值出现在D3站位,其次是A13站位,在D1和A9 2个站位出现了AA的最小值。夏季冷水域AA浓度与Yang等[ 1]报道的南极海域观测到的0.001~0.51 μmol/L基本一致。AA的浓度分布总体呈现出由南到北递增的趋势,这与Chl-a的总体分布较为一致,这表明夏季冷水域表层海水中AA浓度主要是生源控制的,冷水域南部高值区可能是受到了长江冲淡水的影响[ 18]。由于水体中的AA只是一个平衡浓度,它受到AA的来源和去除方式的影响,因而AA的浓度分布与浮游植物量还是存在不一致的地方。夏季冷水域表层水温分布较为均匀,但由于冷水域南部既受到长江冲淡水的影响又受到黄海暖流的影响,从而影响到水体中的营养盐、浮游生物和微生物的量[ 18, 22],并影响到AA的来源和去除,因而该区域呈现了较为复杂的分布特点。
为充分了解AA在黄海冷水域的垂直分布情况,本文选取位于黄海陆架冷水域的A3~A13断面来研究AA在该海域的垂直分布特征及其与各种影响因素之间的关系。
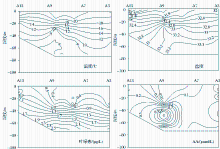
由图3可以看出,在黄海冷水域的垂直方向上,温度、盐度和密度在中层海域中均存在一个较大的温盐跃层和密度跃层[ 22]。A3~A13站位出现跃层的位置分别在5~45,10~40,10~30和7~20 m,并且由北向南逐渐变小。由图4也可以看到,冷水域的温度和盐度均呈现层化现象,温度从表层到底层逐渐减小,盐度从表层到底层则呈现逐渐增大的趋势。
由A系列站位Chl-a的断面图(图4)可以发现,Chl-a含量亦呈现出相似的层化现象,表现为:底层>中层>表层。这可能是由于上层水体受到黄海暖流的影响,营养盐浓度偏低[ 18],造成浮游植物量偏低。而在温跃层以下有封闭的高含量营养盐[ 22],浮游植物量明显偏高。由于强大的温盐跃层和密度跃层的存在,会阻碍营养盐自下而上的输送,从而限制了浮游植物的繁殖和生长[ 23]。
由图4可以看出,在A系列站位的断面分布图中,AA的最高浓度值出现在A9站位的中层,而最小值则出现在A9站位的表层,浓度在检出限以下,变化顺序为:中层>底层>表层。其余站位AA的浓度变化都呈现出:在中层出现最大值,而在表层或者底层出现最小值。对比发现,垂直方向上AA的变化与代表浮游生物量的Chl-a变化趋势并不完全一致,这可能是由于AA的含量并非只受浮游生物量的影响,而是各种环境因素综合作用的结果。李洪波等[ 24]对黄海冷水域中浮游细菌的生态学研究表明:异养细菌生物量在垂直方向上的分布状况是表层>中层>底层。这可能是由于在冷水域中层由浮游植物产生的AA较多,而被细菌消耗较少,小于表层被细菌的消耗量,所以AA在黄海冷水域的垂直分布表现为中层>底层>表层。细菌对AA分布的影响还需要同航次的数据做进一步的探讨。
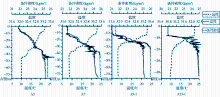 | 图3 冷水域A3~A13站位温度、盐度和密度的垂直变化图Fig.3 Vertical profile of temperature (T), salinity (S) and density (D) at station A3~ A13 in the Yellow Sea cold water mass |
3.3.1 海水中AA与温度、盐度和Chl-a的关系
统计分析结果表明,夏季黄海冷水域的AA浓度与温度、盐度和Chl-a没有显著的相关性。这与AA复杂的来源和去除途径相关,与Gibson 等[ 2]在南极洲的研究结果一致。
但是,表层海水中AA浓度与温度表现出显著的负相关(图5)。这一方面可能是由于海水温度升高,为细菌的生长提供了良好的环境,细菌的含量较多,AA被细菌消耗的量增多,从而导致温度高的海域AA含量较少。另一方面与不同海域DMSP降解产生AA和DMS的程度有关[ 4],在该海域温度越低可能DMSP降解产生AA的量越多。具体原因需要做进一步的研究。
由图5可以看出,夏季冷水域表层海水中AA浓度与盐度无明显相关性。另外,由于在冷水域盐度的变化并不明显,所以对AA的含量并不会产生较大的影响。
从上面的水平分布来看,夏季冷水域表层某些站位AA的分布与Chl-a较为一致,但总体上无显著的相关性(图5),这与AA的影响因素较为复杂有关。
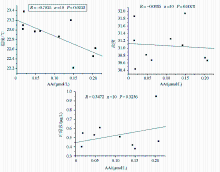 | 图5 夏季冷水域表层海水中AA与温度、盐度和Chl-a的相关性Fig.5 Relationship between the concentrations of acrylic acid and temperature, salinity or Chl-a in the surface waters of the Yellow Sea cold water mass |
3.3.2 海水中AA与DMSP和DMS的关系
因为海洋中生源AA主要是由DMSP降解产生的,一条途径是DMSP降解产生AA和DMS,另一条途径是产生AA和甲硫醇,后者是主要的。因此,研究该海域AA与DMSP和DMS的关系,可以认识海洋中主要含硫化合物DMSP的降解情况。
夏季黄海冷水域中AA浓度与DMSP或DMS总体上无明显的相关性,但表层海水中AA的浓度与DMS略呈正相关,这与现场DMSP,AA和DMS复杂的来源和去除过程有关,在一定程度上也证明了生源AA和DMS同源。
该海域AA与DMS(AA/DMS)的比值为0~564(平均为106∶ 1),可以看到该海域AA的浓度远高于DMS。虽然由DMSP降解可产生等摩尔的AA和DMS,但这只是一个次要途径,另一个主要途径是降解产生AA和甲硫醇,所以海水中DMSP降解产生的AA要高于DMS。另一方面,海水中溶解的DMS可通过海—气交换、微生物消耗和光氧化途径去除,相当不稳定。而海水中AA相对稳定,虽然它也可通过微生物消耗和光氧化去除,这也是海水中AA的浓度远高于DMS的原因。这个结果不同于Yang等[ 1]的报道,南极海域棕囊藻爆发时AA和DMS数量相当,其差异可归为海域环境的不同,如海水的温度、生物种类和生物量等。
海水中生源AA是由DMSP降解产生的,尽管AA和DMSP都是海水中的一个平衡浓度,可以通过下式初步估算DMSP降解的情况:DMSP降解百分数%=AA/(AA+DMSP)×100%,通过计算发现DMSP降解百分数介于0~99.5%之间(平均为66.5%),这也高于Liss等[ 25]报道的南极海域的35%。生物和水文条件的巨大差异可能是造成海域DMSP降解百分数不同的原因。
3.3.3 AA/Chl-a比值
Chl-a常用来表征浮游生物量的多少,DMSP/Chl-a和DMS/Chl-a比值常用来比较不同海域或不同藻类的释放情况,同样,可用AA/Chl-a来评估夏季黄海冷水域产生AA的情况。
夏季黄海冷水域DMSP/Chl-a比值为0~66.7 mmol/g, 平均为15.7 mmol/g;DMS/Chl-a比值为0.06~9.04 mmol/g,平均为1.88 mmol/g;这与黄海的其他航次的观测结果一致[ 26, 27]。而AA/Chl-a比值为0~385.5 mmol/g,平均为126.6 mmol/g。这个比值远高于DMSP/Chl-a和DMS/Chl-a,比DMSP/Chl-a高1个数量级,比DMS/Chl-a高2个数量级。其原因可能与这3种物质的不同来源和去除途径相关。这个结果也高于Gibson等[ 2]报道的南极海域藻华时的32.8 mmol/g。夏季黄海冷水域海水中的AA可能还是受到陆源输入的影响,只是目前无法区分其是生源的还是陆源的。
通过2011年8月对黄海冷水团海域的AA和相关参量的观测,结果表明,在东南部海域的表层海水中出现了AA的高值区,AA的浓度分布总体上与浮游生物量较为一致,这表明夏季冷水域表层海水中AA的浓度主要是生源控制的。AA的垂直分布表现为:中层>底层>表层,这可能是产生AA的浮游植物与消耗AA的细菌共同作用的结果。在夏季黄海冷水域表层海水中,AA与温度表现出明显的负相关性,与盐度、Chl-a无显著相关性。AA浓度与DMSP或DMS总体上无明显的相关性。整个海区内AA/DMS之比为106∶ 1,而DMSP降解产生AA约为66.5%。AA/Chl-a平均为126.6 mmol/g,比DMSP/Chl-a高1个数量级,比DMS/Chl-a高2个数量级。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|