刘贤赵(1970-),男,湖南隆回人,教授,主要从事碳氮同位素与气候环境重建研究.E-mail:xianzhaoliu@sina.com
近年来,由于植物氮同位素组成(15N)记载了气候环境变化的信息,因而被广泛应用于全球变化研究中,成为古气候环境再造和了解现代气候环境变化信息的有力工具。然而,人们对气候环境引起的15N变化及其指示的气候环境意义并不完全清楚,这就有可能限制植物15N在古气候环境变化等领域研究中的应用。在概述植物氮同位素分馏和植物不同氮源的氮同位素分布的基础上,分析了温度、降水、大气CO2浓度和海拔高度等气候环境因子对陆生植物15N的影响以及它们的关系。指出了目前研究中存在的问题及其研究前景,认为在全球变化研究中利用植物氮同位素技术不仅可以重建古气候环境(如重建大气CO2浓度变化),揭示历史时期温度、降水的变化,而且还可以在一定的时间和空间上综合反映生态系统氮循环的特征。
Recently, since stable nitrogen composition (15N) in plants records abundant climate and environment information (such as information on temperature, humidity, precipitation and environment isotopes composition), it has been widely used in paleoclimate studies and becomes a powerful tool for understanding paleoenvironment reconstruction and modern climate change. However, some potential uncertainties have always involved in the reconstruction of paleoclimate and paleoenvironment. Among them, the most dominant uncertainty is due to our poor understanding of the relationship between nitrogen isotope ratios of plants and climatic factors, particularly the relationships among nitrogen isotope ratios, temperature and precipitation. Based on summarizing plant15N fractionation and nitrogen isotope distribution of different N sources, the effects of environmental factors,
气候变化是个重大的环境问题,人们迫切希望通过寻找气候代用指标追索全球气候变化的轨迹来了解过去地球环境的特征并预测未来气候变化趋势。然而,较长时间尺度上的气候变化极为复杂,要较为准确地反演历史气候要素变化、预测未来气候变化趋势,只能借助于某些气候记录来获取一定时空尺度上气候变化的信息。近年来,利用树木年轮、冰芯、洞穴石笋、泥炭纤维素、湖泊沉积物、生物标志物等气候代用指标进行全球气候变化研究已取得了重要进展[ 1, 2, 3, 4, 5],其中碳、氮、氢、氧等稳定同位素在古气候、古生态环境重建以及古食性研究等领域中得到了广泛的应用[ 6~ 9]。特别是沉积物中有机组织的氮同位素组成( δ15N),它不仅能指示有机质的来源和分布,而且还可以用来重建其沉积历史和古环境[ 10, 11],因而成为近年气候环境变化研究的热点。由于沉积物中的有机质主要来自陆生植物,在对由沉积物得到的氮同位素结果进行解释时,涉及到陆生植物 δ15N问题,而陆生植物 δ15N在不同气候环境下存在很大的差异,因此详细了解现代植物 δ15N与气候环境因子之间的关系成为正确解释陆相沉积物 δ15N和可靠提取古环境信息的基础。
氮是影响和限制植物生长最重要的营养元素之一。植物组织的氮同位素在很大程度上受到生长环境的影响,测定植物组织中的 δ15N可以在一定的时间和空间上揭示与植物生理生态过程相联系的一系列气候环境信息。目前,植物 δ15N作为一种较新的高分辨率分析技术,不仅被广泛应用于植物生理生态、土壤¾植物¾大气系统和地表、地下水污染源识别以及全球氮循环研究,而且还被从事全球变化或古气候研究的学者应用于古气候与古环境的重建研究中[ 10, 11, 12, 13, 14, 15, 16],成为获取古气候变化信息的有力工具。然而,人们对气候环境引起的 δ15N变化及其指示的气候环境意义并不完全清楚,这就有可能限制植物 δ15N在古环境、古生态和全球气候变化等领域研究中的应用。本文旨在概述气候环境变化(大气CO2浓度、温度、降水和海拔)对植物 δ15N组成的影响以及它们与植物 δ15N之间的关系,并就研究中存在的问题及研究前景进行简要地探讨,以便让更多的读者对本领域有较全面的了解,最终拓宽本领域的发展。
1植物氮同位素分馏及其N源的氮同位素分布
植物氮同位素组成通常用式 δ15N(‰)=( Rsample/ Ratmosphere-1)×1000来表示。由于生物地球化学过程中的同位素分馏(轻同位素优先于重同位素参加反应)使得氮同位素成为氮素迁移转化过程中的一种有效的示踪手段,并在植物生理生态和气候环境变化研究领域中发挥着不可替代的作用。一般情况下,大气中的N2通常是不能被植物直接吸收的。只有一些固氮植物,特别是豆科植物,依靠与其共生于根部的根瘤菌直接把大气中的N2转化为NH3,然后被植物吸收。此外,一些藻类和菌类也可以直接转化大气中的N2而吸收N。在此过程中氮同位素的分馏很小,豆科植物 δ15N与大气 δ15N(0‰)接近。其他植物,则不能利用此途径来获取N,必须从其他N源中吸收NO3-和NH4+来获取维持正常生理功能所需要的N,最后形成植物有机质。在N的转化过程中,由于N的2种同位素(14N、15N)反应所需能量不同,其反应速率会存在差异,从而引起氮同位素分馏发生,导致产物相对底物富集14N。根据Tcherkez等的研究[ 17],以NO3-作为N源的植物氮同位素分馏模式可概化为图1,用式表示为
Δ=δ15Ne-δ15Np=a+(b-a)ni/ne (1)
式中: a为植物吸收NO3-过程所发生的氮同位素分馏, b为植物同化NO3-并被转化成植物有机质产生的氮同位素分馏, ne为N源中NO3-浓度, ni为植物体内NO3-浓度, δ15Np、 δ15Ne分别为植物和N源的 δ15N。
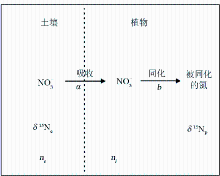 | 图1 植物吸收和同化氮的概化分馏模式(据文献[ 17]修改)Fig.1 Generalized fractionation pattern of nitrogen uptake and assimilation by plants (modified from reference [17]) |
前人的研究认为[ 18, 19],植物在吸收NO3-的过程中基本上不发生同位素的分馏, a接近于0;植物吸收N到形成植物有机质的过程中氮同位素分馏主要发生在NO3-通过硝酸盐还原酶(NR)还原成NO2-过程和谷氨酰胺(Gln)合成过程中, b值变化在15‰~17‰之间。从公式(1)可以看出,植物的氮同位素分馏主要取决于外界N的浓度和植物N的需求。Mariotti等的研究[ 20]证实了这一认识,发现生长在0.5 mmol/L NO3-溶液中的狼尾草仅有很小的同位素分馏,而当NO3-溶液浓度达到12 mmol/L时,同位素分馏为3‰。上述植物氮同位素分馏程度与外界NO3-浓度成正比的结果也适合于以NH4+作为唯一N源的植物。例如,生长在1.4mmol/L NH4+环境中的水稻的氮同位素分馏为4.1‰,但当NH4+溶液浓度达到7.3 mmol/L时,其同位素分馏则为12.6‰[ 21]。尽管植物在氮同化过程中也存在氮同位素分馏,但由于植物在生态系统中对N的需求往往大于N的供应,从而使植物 δ15N与外界N源的氮同位素基本一致[ 21]。
植物对N的获取不外乎植物本身的固氮和对土壤氮的吸收。因此,在自然生态系统中,植物的N源主要包括大气、土壤、雨水中的N以及动植物腐殖体和牲畜排泄物中的含N物质。由于氮同位素的分馏,导致植物土壤大气系统中各种N源的 δ15N明显不同,大多数含N物质的 δ15N集中在-10‰~ +20‰[ 22],其变化区间与土壤 δ15N的分布范围基本一致(表1)。其中, δ15N<0的分布与雨水的 δ15N范围较接近。在生物组织的 δ15N分布范围内,豆科植物的 δ15N值与大气N2的 δ15N值相近,大约为 0‰ ± 2‰;非豆科植物具有较高的 δ15N,为 -10‰ ~ 9‰;动物组织的 δ15N直接取决于其食物中的同位素组成,但在此过程中同样存在着同位素的富集现象,沿营养级每上升一级,大约富集2‰ ~ 3‰[ 23],即食草类动物的 δ15N要比其所吃食物富集3‰~4‰。由于植物 δ15N是其生长环境(如温度、降水、土壤水分、海拔) 和具有不同 δ15N值的多个N源共同作用的结果,故此,可以根据不同物质的 δ15N值来识别植物¾土壤¾大气系统中含氮物质的来源,以及通过建立植物 δ15N与气候环境因子之间的关系来提取其环境变化的信息,并将结果应用于古气候、古生态环境的重建。
| 表1 不同物质的氮同位素值分布(据文献[23~28]整理) Table 1 δ15N values distribution of different substances (summarized from reference [23~28]) |
植物 δ15N对气候环境变化的响应一直是人们关心的问题。早在20世纪70年代末,Shearer等[ 29]就开始了对土壤氮同位素的研究。进入20世纪80年代后,人们对植物氮同位素的变化以及气候环境因子对植物氮同位素的影响进行了广泛的研究。尽管影响植物 δ15N的气候环境因子很多,但在全球气候变化、古生态和古环境的重建研究中,人们最关注的是温度、降水(土壤水分)和大气CO2浓度与植物氮同位素的关系。原因是温度、降水和大气CO2浓度是影响植物氮同位素变化最主要的气候环境因子,因此利用植物 δ15N可获取生长环境中温度和降水等气候变化信息。
温度是影响植物δ15N最重要的气候环境因素之一。大量的研究表明[ 15, 30~ 33],在全球尺度上和较小的区域范围内,陆地植物及其相应的土壤 δ15N与其生长温度呈正相关,即随温度升高,植物 δ15N增加。如Martinelli等[ 34]对来自美国、巴西、泰国、非洲和欧洲一些地区的植物 δ15N比较之后,发现来自热带地区的植物平均 δ15N值要比来自温带地区的偏正6.5‰。刘晓宏等[ 12]的研究也发现,东非大裂谷埃塞俄比亚段内C3植物的 δ15N与年均温度呈极显著正相关,温度每增加1℃,植物 δ15N偏正0.5‰。但在另一些研究中,人们发现植物 δ15N与温度的关系出现与上述不一致的情形。如Craine等[ 35]的研究认为,在全球尺度上植物 δ15N与年均温度(Mean annual temperature, MAT)并不是简单的线性关系,在MAT <-0.5℃的生态系统中,植物 δ15N值没有随温度的变化而出现有规律的变化,而在 MAT≥-0.5℃的生态系统中,植物 δ15N值随温度的增加而偏正,其变化速率为0.23 ‰/℃。刘卫国等[ 36]对黄土高原的研究结果与上述相反,发现黄土高原植物根系、植物残体的 δ15N值随年均温度和生长季温度(6-8月)增加呈现偏负的趋势。我们在北京东灵山地区发现不同生活型植物 δ15N对温度的响应明显不同[ 15],表现为乔木(白桦)和灌木(山杏、荆条)的 δ15N与MAT呈上升趋势,而草本植物 δ15N与年均温度呈二次曲线关系,当温度<3.5℃时,植物 δ15N随温度升高而偏负,而当温度高于此值时 δ15N随温度增加而偏正。
由于植物氮同位素分馏受一系列内部和外部因素的影响,所以目前关于温度影响植物氮同位素分馏的机制仍不是很清楚,但有一些相关的解释被提出:①植物 δ15N与温度呈正相关的关系可能与较高的温度提高了土壤的净硝化潜力或者增加了土壤氮循环的开放性有关[ 37, 38]。这是因为植物对土壤无机N的吸收过程中N同位素的分馏很小[ 39, 40], a值接近于0;且在此过程中微生物的分馏作用又受温度的影响。温度升高时,土壤硝化细菌和氨化细菌的生物活性加强,土壤矿化/硝化速率加快,土壤无机氮有效性增强,从而产生富集15N的土壤N库。由于植物 δ15N与土壤 δ15N具有很好的正相关性(图2),从而使植物 δ15N增大[ 32, 41, 42]。这种说法似乎能够解释山区植物 δ15N随温度降低(海拔增加)而变轻,但较难解释黄土高原植物 δ15N随温度增加而偏负。而Liu和Wang把黄土高原植物 δ15N与温度呈负相关的趋势归结为“雨热同期”效应,即增加降水影响导致植物 δ15N组成的偏负效应大于受温度增加导致的植物 δ15N组成的偏正效应[ 36]。这意味着黄土高原植物土壤 δ15N组成与温度的这种负相关趋势并未真正反映该区植物 δ15N与温度的关系,该区植物 δ15N的变化究竟是由气候因素中的水分主导还是由温度主导并不是很清楚。②植物 δ15N随温度的变化与生长季温度高于或低于其生长的最适温度有关[ 43]。在具有一定海拔高度的山区,在某一海拔高度以上,温度可能是影响植物生长的限制因子,而植物生长的限制因子往往也是植物同位素分馏的控制因子。这一点可以解释我们在北京东灵山海拔1 350 m以上地区植物 δ15N与温度呈负相关的结论[ 15]。尽管上述第二种解释较好地回答了为什么前人既有正相关、也有负相关的结果,但这一解释仍待检验。因为作者在贡嘎山东坡沿海拔梯度对250种植物422个植物样品(其中22个为C4植物)的调查中[ 32],并没有发现植物 δ15N与温度之间表现出显著的非线性关系(图3),也没有发现出现明显的“拐点”,而贡嘎山东坡海拔为7 556m,植物生长的最大高度达4 500 m,远高于东灵山2 300 m。
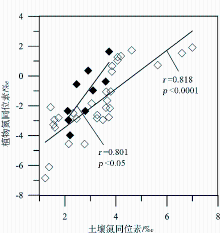 | 图2 贡嘎山东坡表层土壤氮同位素与植物氮同位素关系[ 32]Fig.2 Correlations of surface soil15N and leaf15N for C3and C4 plants occurring on the eastern slope of Mount Gongga[ 32] |
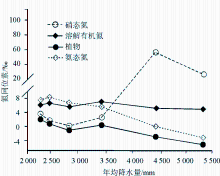
降水也是影响植物氮同位素组成的一个重要因素。在全球尺度和较小的区域范围内(如南非、澳大利亚北部、澳大利亚IGBP样带、东非大裂谷埃塞俄比亚段),都发现植物 δ15N随年均降水量的降低而增大[ 13, 38, 40, 44~ 47],即 δ15N在干旱地区大于湿润地区。Austin和Vitousek在夏威夷岛屿沿一个降雨梯度带测定植物和土壤氮同位素时,发现植物和土壤的 δ15N随降雨量增加而变轻,降水量每增加100 mm氮同位素偏负0.3‰ ~ 0.4‰[ 48]。Handley等[ 49]和Julieta等[ 50]在调查全球陆地植物 δ15N与降水量的关系时也得到了类似的结论。图4是Robinson[ 14]根据Handley等的调查资料整理出来的结果,该图清楚地显示了植物 δ15N与年均降水量呈显著负相关关系。但Craine等的研究认为[ 35],这种负相关关系仅适合于非固氮植物,而对于那些具有潜在固氮能力的植物,它们的氮同位素值与年均降水量不存在相关性。Vitousek等[ 51]在夏威夷热带雨林地区得到的 Metrosideros polymorpha植物 δ15N不随降水量而发生变化的现象为此提供了证据。也有个别研究得出相反结果的,如Heaton[ 47]研究发现,生长在纳米比亚海岸带高降水量的植物 δ15N比附近干旱地区的植物 δ15N偏正5‰,Codron等[ 52]在南非热带稀树草原也发现,干旱条件下的植物 δ15N明显低于潮湿条件下植物的 δ15N。Aranibar等[ 40]把这种植物 δ15N随干旱程度增加而变重的原因归结为降水的较大变化和不可预见性,而不认为是干旱地区较低的年均降水量的作用。此外,不同研究区域植物 δ15N对降水量的响应程度不同。如刘晓宏等[ 12]在研究东非大裂谷埃塞俄比亚境内植物氮同位素与降水量的关系发现,年降雨量每增加100mm,植物 δ15N偏负1.0‰,Swap等[ 45]在南非调查时也发现,年均降水量每增加100mm,植物 δ15N偏负0.68‰,我们在北京东灵山的研究也发现,年均降水量每增加100 mm植物 δ15N偏负2.24‰[ 15],这与在全球范围内得到的植物 δ15N变化速率(-2. 6‰/100mm)一致[ 16]。
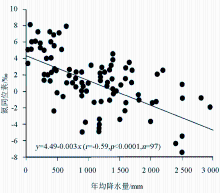 | 图4 植物氮同位素随降水的变化[ 14]Fig.4 Variation in plant15N values with the changes in mean annual precipitation[ 14] |
目前,植物 δ15N随降水增加偏负的机理还缺乏令人满意的解释。Sutton等[ 53]将降水增加引起植物 δ15N降低解释为植物叶片通过气孔或表皮直接吸收了雨水氮中的NH4+,原因是降水氮中铵态氮的 δ15N往往较硝态氮偏负。但前人的研究[ 39, 40, 54]认为,植物 δ15N的富集主要来源于对土壤无机氮的吸收,而植物 δ15N随降水的变化主要与降水影响土壤有机氮向无机氮的转化(土壤中有机氮的矿化引起的同位素分馏仅在±1‰间波动)以及无机氮的损失有关。无机氮的损失主要有3种途径:硝酸盐淋溶、氨挥发和反硝化作用。尽管硝酸盐淋溶本身没有分馏作用,但土壤中的氮素在发生硝化/反硝化作用和挥发过程中会导致NH4+-N和NO3--N含量的变化,在这个过程中都伴有氮同位素分馏。由于硝化作用,土壤中的NH4+-N一般比NO3--N更富集15N。在上述 δ15N变化的不同分馏过程中,微生物(硝化细菌和氨化细菌)往往起着至关重要的作用。当降水量过多或土壤湿度过大时,土壤微生物活性降低,呼吸速率剧减,土壤净硝化作用受到抑制,土壤无机氮的有效性降低,从而使土壤贫15N,导致植物 δ15N变轻[ 55];而在干旱环境下,由于降水减少,土壤氨化作用和反硝化作用增强,氮循环开放度增加,土壤N库富集15N,最终使植物 δ15N增大[ 38]。然而,Benjamin等认为[ 56],植物 δ15N随降水增加而变小是由于降水量的增加改变了植物利用的N源。理由是他们在夏威夷茂伊岛山区宽广的降水跨度范围内(2 200~5 050mm) 调查热带雨林植物 δ15N时,发现不同土壤N源的氮同位素发生了突变,即随降水量增加土壤硝态氮 δ15N在降水量3 450 mm处急剧增大,而铵态氮 δ15N迅速降低,植物从以硝态氮为主要N源转向为以铵态氮为主要N源,最终导致植物 δ15N随降水增加而减小(图5)。
自工业革命以来,全球大气CO2浓度迅速上升。大气CO2浓度的变化不仅影响全球气候变化,而且还影响植物的生长发育、土壤生态系统氮循环以及微生物活性,进而影响植物对N素的吸收,最终导致植物 δ15N变化。然而,关于大气CO2浓度对植物 δ15N影响的报道不多。现有的研究显示,植物 δ15N随CO2浓度上升呈下降趋势。如Hormoz等[ 57]对来自沙漠、温带森林、地中海型亚热带常绿硬叶林、草甸草原和农业等5个生态系统的27种植物的 δ15N研究得出,生长在高CO2浓度下的植物叶片 δ15N显著低于生长在正常环境条件下的植物( P<0.038),这与Dijkstra等[ 58]对向日葵( Helianthus annuus)研究的结果一致,且进一步的分析发现,在CO2浓度为190~580 μmol/mol的较大范围内,生长6年的2个丛林灌木叶片的 δ15N与CO2浓度呈显著的负相关关系;Charles等[ 59]通过一个自由大气CO2浓度富集实验,发现枫香( Liquidambar styraciflua L.)叶片凋落物 δ15N在1998—2008年呈下降趋势,并且下降的速率显著快于CO2浓度增加的幅度。但是,也有结果与此相反的,Billings等[ 60]在莫哈韦沙漠发现矮橡林( Larrea tridentata)叶片 δ15N随CO2浓度升高而变重,而土壤 δ15N无明显变化。
随着人们对大气CO2浓度变化对植物 δ15N影响认识的不断深入,一些研究表明,长期大气CO2浓度升高会导致氨化细菌和硝化细菌活性降低,进而使土壤矿化能力和硝化作用下降,土壤中的N浓度和N的有效性降低[ 61, 62],从而导致植物 δ15N偏负。这种说法较好地回答了为什么植物 δ15N随CO2浓度升高而偏负,但较难解释Billings等得到的植物 δ15N与大气CO2浓度呈正相关的结论。这是因为,Billings等也发现随CO2浓度升高,土壤N有效性降低,而植物 δ15N反而增大。我们认为大气CO2浓度上升导致植物 δ15N增大可能有3个方面的原因:①大气CO2浓度升高提高了植物的净光合能力和生长代谢水平,使植物体内碳同化产物增加,进而为土壤微生物提供了充足的碳基质,促使微生物活性增强[ 63],土壤无机N生物固定增加,而微生物酶过程会对15N产生分馏作用,导致剩余的植物有效无机N库富集15N,从而使植物 δ15N增大;②大气CO2浓度上升可能导致土壤N有效性提高[ 64],N循环开放度增加,贫瘠15N气体N的损失和贫瘠15N硝酸盐的淋失导致土壤残留N库15N的富集,最终导致植物 δ15N增大。Billings等得出的植物 δ15N与CO2浓度呈正相关的结论可能与大气CO2浓度升高导致的土壤无机N生物固定对植物有效N库富集15N的影响大于土壤N有效性降低对植物 δ15N的影响有关。③大气CO2浓度升高可能导致植物吸收利用N源的变化。Bassirirad等[ 65]研究发现,随CO2浓度的升高,火炬松( Pinus taeda)和杰克松( Ponderosa pine)对硝态氮的吸收显著增加,而对铵态氮的吸收却明显下降。由于不同N源的 δ15N存在显著差异,从而CO2浓度变化对植物 δ15N产生影响。至于大气CO2浓度升高条件下植物N吸收形态的改变可能与两个因素有关:一是植物根系的能量状态。因为NO3-的吸收和同化对植物的能量状态比NH4+敏感,大气CO2浓度升高时,植物体内呼吸底物增多,根际呼吸的加强可能导致能量状态的改善,从而有利于NO3-的吸收和同化。二是根际高含量CO2通过增加根表皮细胞内HCO3-的含量影响对NO3-的吸收[ 66]。
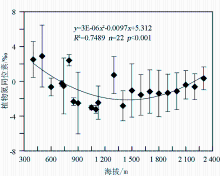
关于植物 δ15N随海拔高度的变化,国内外已有较多的研究[ 12, 15, 55, 67]。尽管如此,但对于植物 δ15N随海拔高度变化规律的认识,学术界仍存在分歧。多数研究认为,不管是单个植物种还是整体植物,其 δ15N均具有随海拔高度增加而逐渐变轻的趋势。如Liu等[ 12]对东非大裂谷C3植物 δ15N随海拔变化的结果显示,海拔每增加100 m,植物平均 δ15N偏负0.2‰;Sah和Brumme[ 55]在尼泊尔的研究也表明,高海拔地区的植物 δ15N明显小于低海拔地区。但也有一些结果与之不同甚至相反,Bai等发现固氮植物叶片的 δ15N与海拔高度不相关[ 67],Vitousek等[ 51]在夏威夷火山国际公园也得到了类似的结果,而Yi等[ 43]在青藏高原3 250~4 300 m的海拔范围内,发现高寒草甸植物 δ15N随海拔升高有逐渐变重的趋势,但不显著。通过对北京东灵山地区植物氮同位素的系统调查[ 15],发现植物 δ15N平均值与海拔呈二次曲线关系(图6),海拔低于1 350 m时植物 δ15N与海拔高度呈负相关,高于此值时则表现为正相关。对于上述各种不同的结果,Mariotti等[ 20]把山区植物 δ15N随海拔高度增加而逐渐偏负的原因归结为随海拔上升所引起的降水增加和温度降低的影响,而Yi等[ 43]则认为植物 δ15N与海拔出现正相关的情形可能与海拔升高引起降水减少和蒸发量增大而导致的水分胁迫有关。Amundson等[ 16]在总结已发表的研究结果后,认为在局部地区植物 δ15N随海拔的变化也可能出现正相关或变化趋势不明显的情形,这主要是由于植物 δ15N组成不仅受局部微生境的影响,而且还受复杂的植物生理、土壤氮素转化等一系列生物地球化学过程的控制。
海拔本身并不会对植物 δ15N产生影响,但海拔高度的变化会引起温度、降水、光照和土壤环境(土壤温度、水分、养分以及微生物活性等)以及植物叶片形态、植物生理特性等方面的变化,而上述生长环境的变化会通过影响土壤 δ15N最终对植物 δ15N产生影响。根据Garten[ 33]的研究,植物 δ15N随海拔升高而降低与土壤净硝化能力有关。这是因为:①土壤氮素的矿化/硝化作用可以指示土壤N素的有效性,土壤的净氮矿化/硝化作用越强,说明土壤N的有效性越强。通常植物 δ15N与土壤净硝化作用呈正相关,高海拔地区因温度较低,土壤的净硝化能力明显要弱于低海拔地区,从而导致高海拔地区土壤无机氮有效性降低,而土壤无机氮又是植物的主要N源;②土壤氮同位素的分馏过程与微生物活动有关,微生物的活性与种群大小又和土壤温度、水分含量等密切相关。在低海拔地区,由于土壤温度相对较高而降水相对较少,较干暖的环境使土壤硝化细菌和氨化细菌活动加强,土壤矿化/硝化速率较快,土壤NO等气体通量增大,而微生物在吸收同化无机氮的过程中优先吸收同化14N,从而导致土壤富集15N;而在高海拔地区,冷湿的环境使土壤微生物活性降低,土壤呼吸速率剧减,土壤中轻同位素14N富集,相对于低海拔地区植物则贫15N。至于随海拔高度变化引起的一系列环境因素对植物 δ15N组成影响的叠加效应和分馏机制仍然不很清楚。
植物 δ15N除了受温度、降水、大气CO2浓度和海拔高度等的影响外,其它气候环境因子如光照、土壤条件(土壤母质、土壤水分、PH值、土壤N营养状况和土壤 δ15N等)、盐分胁迫和环境污染等均会间接影响植物的 δ15N,并且这些因素随纬度、坡向和季节等也会发生不同程度的变化,从而使植物 δ15N受气候环境变化的影响变得更加复杂。
众多研究表明,植物 δ15N在进行古气候重建和预测未来环境变化以及全球氮循环研究中发挥了重要的作用,并显示出巨大的应用潜力,但仍存在一定的局限性,在今后的研究中对下述问题需要进一步探讨。
(1) 植物 δ15N与气候环境因子间的关系难以准确确定。这是因为,植物的 δ15N组成除了受植物本身的生物学特性决定外,同时还受植物N源和气候环境的控制。生长环境的变化一方面可能改变植物生长区原有N的形态、浓度和赋存状态,从而影响N对植物的供应;另一方面,气候环境的改变可能引起植物生长区水热利用状况的变化,从而影响植物的生理生态,使植物对N素的吸收利用发生改变。尽管目前许多学者建立了植物 δ15N与气候环境因子的关系,但多数结果都包含了各种环境因子的交互作用,很难区分单一环境因子对植物 δ15N的影响,使得利用这一结果去解释沉积物中的氮同位素所包含的气候环境信息时带有很大的不确定性。因此,有必要分离各种环境因子对植物 δ15N的影响,真正建立起植物 δ15N与气候环境因子的准确关系,确保结果的可靠性。
(2) 现有结果大都十分零散,代表性不强。以植物 δ15N与温度的关系为例,目前建立的植物 δ15N-T关系多数是在物种水平上进行的,而且涉及的物种较少且多是木本植物,对于冠层、群落、生态系统乃至全球尺度上的相关研究甚少。尽管Amundson等[ 16]对全球范围内陆地植物 δ15N与温度的关系进行了研究,但也存在明显不足:①数据来源有限。在Amundson等使用的数据中,有1/3的数据来自Martinelli等[ 34]发表的一篇论文,而中国大陆数据极少,世界寒带生态系统的数据几乎为零;②在建立的植物叶片 δ15N与温度的关系中,使用的 δ15N数据有的是来自落叶或叶片纤维素,Amundson等没有修正就直接进行了引用,同时也没有区分草本、灌木、乔木植物的作用,而不同生活型植物 δ15N对温度的响应不同。因此,今后应该加强冠层、群落、生态系统乃至全球尺度植物 δ15N的研究,逐渐从新的角度探讨植物 δ15N与环境因子的关系。
(3) 目前大部分研究主要集中在C3植物 δ15N与气候环境因子的关系,对C4植物研究极少。由于不同光合型植物对不同形态氮源的吸收具有选择性,因而C3、C4植物 δ15N对环境因子的响应必然存在差异。据Aranibar等对南非植物 δ15N的调查[ 40],发现C4植物的 δ15N显著小于来自相同样点的C3植物。这意味着利用植物 δ15N结果去解释陆相沉积物 δ15N所包含的气候环境信息时,C3/C4植物的比例将影响到解释结果的准确性。因而加强C4植物 δ15N与气候环境因子的关系研究也是定量重建古气候的基础。此外,在探讨植物 δ15N与环境因子的关系时,目前多数研究都是选择非固氮植物,而对于那些具有潜在固氮能力的豆科植物,它们的氮同位素组成与环境因子是否存在相关性仍然不清楚,因此查清固氮植物 δ15N与环境因子之间关系很有必要。
(4) 影响植物 δ15N的机制还不是很清楚。目前对于植物 δ15N与环境因子关系的解释多是基于土壤N有效性或土壤N循环开放度,认为气候环境因子的变化会对土壤微生物活性产生影响,进而影响土壤N的有效性或N循环开放度,最终影响植物 δ15N。虽然Benjamin等[ 56]把植物 δ15N随降水增加而变轻解释为降水量的增加改变了植物利用的N源以及土壤不同N源的 δ15N,但降水增加为何引起土壤硝态氮 δ15N增大、铵态氮 δ15N降低以及高降水条件下土壤硝态氮 δ15N大于铵态氮的原因仍不清楚。此外,关于大气CO2浓度是通过提高土壤无机N的生物固定来促使植物 δ15N增大,还是通过提高土壤N有效性来增加植物 δ15N目前也仍无定论。因此,进一步研究气候环境因子变化条件下(如大气CO2浓度升高)土壤N矿化作用是否增强、微生物与植物是否对有效N存在竞争以及植物N素吸收形态是否发生改变等对全面理解植物 δ15N对气候环境因子的响应机理无疑是必要的。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|



 15N) of plants and soil nitrogen might allow the characteristics of N transformation in an ecosystem to be detected. We tested the measurement of
15N) of plants and soil nitrogen might allow the characteristics of N transformation in an ecosystem to be detected. We tested the measurement of