土壤是人类赖以生存与发展的基础, 是地球系统大气圈、水圈、岩石圈及生物圈相互作用最复杂、最活跃的交界面。土壤中的微生物数量巨大、种类繁多, 是联系不同圈层物质与能量交换的重要纽带, 被称为地球关键元素生物地球化学循环过程的引擎, 但长期以来理论与技术发展滞后并制约了土壤微生物学研究, 阻碍了对土壤过程和地球表层系统关键过程的深入认识。21世纪初, 土壤微生物的1分类理论渐具雏形, 先进技术的开发应用发展迅猛, 成为不同学科交叉发展的重要前沿。国家自然科学基金委员会地球科学部一处紧紧围绕学科发展方向, 深入分析了土壤微生物及其相关项目的申请趋势, 并于2005年1月组织了国内相关领域同行, 主持召开了“土壤生物与土壤过程”学术研讨会, 结合国际科学前沿与国家战略需求, 明确了当时我国土壤微生物学的主要任务与重点领域, 积极引导了我国土壤微生物学的发展方向。过去10年来, 在国家自然科学基金委员会地球科学部一处和国家相关部门的大力支持和指导下, 我国土壤微生物学研究在土壤养分元素转化、全球环境变化与污染环境修复等方面取得了长足发展, 在此对部分成果简要综述, 期望能在新形势下, 进一步凝练科学共识, 把握学科发展前沿, 提升理论创新能力, 推动我国土壤微生物学的进一步发展。
Soils are fundamental to preservation and sustainability of life-support system on Earth. Soils develop as the most dynamic and complex interface linking atmosphere, hydrosphere, lithosphere and biosphere. Soils harbor enormous diversities of microbial communities as the primary driving forces for global exchanges of matter and energy on our planet. Despite of its profound importance, the invisible soil microbes have for long been underappreciated. In the early 2000s, there has been growing awareness that soil microbiology has attracted huge interest from nonsoil scientists due to the introduction of threedomain phylogeny. It is also known as tree of life theory which is widely recognized as the most accurate reflection of the relatedness of all organisms and provides us with a tool to classify and elucidate the largely untapped resource of soil microbial communities. In January 2005, the Department of Earth Sciences of National Natural Science Foundation of China organized a workshop of ‘Soil Biology and Soil Processes’ with focused discussion on soil microbiology research frontiers. The workshop outlined research priorities, crossdisciplinary research opportunities, technological needs and potential breakthroughs within soil microbiology. This workshop has witnessed the rapid advances of soil microbiology in soil nutrient transformation, global environmental changes and environmental remediation over the last decade in China. This article will give a brief review on soil microbial researches in the past decade in China, present the status quo of funding system and highlight the challenge and opportunities for future soil microbiology in China.
土壤是地球演化过程中形成的历史自然体, 是地球环境的重要组成, 是人类赖以生存生活的载体, 也是保障国家粮食安全最基本的生产资料。然而, 高强度的人为干扰可导致土壤中氮磷等生源要素及外源污染物的过量积累并产生环境污染。同时, 土壤在全球环境变化中的作用日益得到重视, 土壤作为温室气体(如CH4, N2O等)的重要排放源, 深刻影响地球环境并得到各国政府的广泛关注。事实上, 人类文明演替历史上, 不合理的开发与利用极可能引起土壤资源耗竭并导致整个文明的衰败, 如古代巴比伦文明的湮没。在科学技术高度发达的今天, 深刻理解土壤内部过程与陆地表层系统变化过程与机理不仅成为可能, 也是我国农业生产与生态安全的重要研究内容。
微生物是土壤最活跃的组成。从定植于土壤母质的蓝绿藻开始, 到土壤肥力的形成, 土壤微生物参与了土壤发生、发展、发育的全过程。土壤微生物在维持生态系统整体服务功能方面发挥着重要作用, 常被比拟为土壤碳/氮/硫/磷等养分元素循环的“转化器”、环境污染物的“净化器”、陆地生态系统稳定的“调节器”。同时, 土壤又为微生物生长和繁殖提供了良好的物理结构与化学营养, 是微生物最好的“天然栖息地”。土壤物质组成、理化过程和微环境的高度异质性, 导致土壤被认为是地球上“微生物多样性”最丰富的环境。据估算, 每克土壤中约含数万个物种, 100亿左右微生物, 而其中仅有1%的物种可通过分离培养进行研究。目前我们对土壤中绝大多数微生物多样性与功能的认识十分有限, 土壤微生物研究已成为国际关注的热点问题。如最近《自然》刊发观点论文, 将土壤中的微生物比拟为物理学中的暗物质, 提出了“生物暗物质”的理念[ 1]。
土壤微生物学的发展始终依赖于研究方法的突破和改进。19世纪末建立的经典分离培养和稀释平板计数法是土壤微生物研究的重要里程碑, 但土壤微生物数量巨大、种类繁多、传统方法遗漏了土壤中绝大多数微生物, 难以反映土壤微生物群落的丰度及其作用机制。因此, 土壤微生物多样性及其功能常被认为是尚未解密的黑箱。20世纪70年代土壤微生物量分析方法的建立, 则有效量化了土壤碳/氮/磷等养分元素的微生物周转过程, 极大地推动了土壤微生物学的生物化学过程研究。20世纪90年代后期rRNA为基础的生物三域分类理论逐渐得到学术界广泛认可, 以16S rRNA核苷酸序列组成为基础的分子技术根本改变了传统土壤微生物学研究的基本理念, 显著推动了土壤微生物原位表征技术的发展。土壤微生物学的研究对象也从单个的功能基因拓展到系统的宏基因组和转录组;从单一的菌种资源纵深发展到整体的土壤微生物群落。这些新理论与新技术的应用, 使得深入挖掘土壤微生物资源, 定量描述土壤微生物过程, 定向调控土壤微生物功能成为可能, 土壤微生物迅速成为世纪之交的国际科学研究热点之一。
19世纪中叶, 学术界已经将土壤内部的三大过程(土壤有机质的分解、硝化和固氮作用)清晰界定为生物过程, 对这些土壤内部过程的机理探索直接催生了土壤微生物学, 并导致20世纪初土壤微生物学的空前繁荣[ 2]。新中国成立15年时间内, 在张宪武、陈华葵和樊庆笙等著名土壤微生物学家积极推动下, 我国土壤微生物学从无到有, 发展迅猛, 在土壤生物固氮和稻田土壤氮素微生物转化等方面已经接近或达到当时的国际先进水平, 在此基础上, 改革开放后我国陈文新教授也在土壤根瘤菌方面取得了国际先进水平的成果。在这一时期, 由于技术手段的限制, 我国土壤微生物研究与国际同行具有相似的历程, 更多地关注特定功能微生物的分离, 更多地侧重个体微生物的生理生化研究, 对原位土壤中微生物区系的研究大多处于一种描述状态。20世纪90年代后期, 以聚丙烯酰胺凝胶电泳(DGGE)、末端限制性片段长度多样性(T-RFLP)、克隆文库和DNA测序等为代表的分子技术引入土壤微生物研究, 国际上以土壤微生物为核心的陆地表层系统变化过程与机理研究方兴未艾, 我国土壤微生物学研究也重新得到了不同领域、不同学科的高度关注, 特别在21世纪初, 国家自然科学基金委地球科学部土壤生物学科的基金申请项目的增长态势特别突出, 但其时我国土壤微生物学的研究重点较为分散, 优势团队难以集聚, 系统集成功能薄弱, 导致整体研究水平仍落后欧美发达国家。因此, 国家自然科学基金委地球科学部一处在前期充分调研的基础上, 结合我国土壤微生物学研究的特点, 2005年1月在北京组织召开了“土壤生物与土壤过程”研讨会, 主要目的是引导国内土壤学基础研究队伍, 重视土壤生物学的学科体系建设和青年人才培养, 把握国际最前沿的研究方向和技术, 强调生物过程在土壤研究中的作用, 改变以往土壤学研究以宏观过程研究为主的状况, 促进土壤宏观与微观过程研究的紧密结合, 加强土壤过程研究及土壤质量变化过程的机理研究。会议邀请了国内30余位专家参加, 其中半数以上做了主题发言, 主要围绕:①当前国际土壤生物与土壤过程研究的现状、动态与挑战, ②土壤生物在土壤物理、土壤化学过程中作用及其耦合机制, ③土壤生物在污染生态过程中的功能与作用, ④土壤生物与植被互动的机制与生态效应, ⑤我国土壤生物学研究所面临的挑战和机遇以及未来5~10年应关注的重要科学问题。
在国际土壤微生物学蓬勃发展之际, “土壤生物与土壤过程”研讨会为我国土壤微生物研究人员提供了良好的交流平台, 探讨了土壤微生物学的国际发展前沿, 明确了当时我国土壤微生物研究的主要任务, 凝聚了土壤微生物学重点领域的研究共识, 积极引导了我国土壤微生物学的发展方向。此后, 在国家自然科学基金委地学部一处等部门的大力支持和指导下, 我国土壤微生物学研究取得了长足发展, 在土壤微生物量为基础的表观动力学过程研究、土壤氮素转化为核心的微生物机理过程、土壤微生物相互作用介导的有机质降解过程、微生物与矿物相互作用、土壤-植物根系-微生物之间的相互作用、微生物过程与环境污染修复等方面均取得重要进展, 为未来我国土壤微生物学发展奠定了坚实的基础。
由于土壤微生物的存在, 使土壤成为一个活的生命体。土壤微生物在土壤中度过他们全部的或者部分的生命历程, 并在土壤内部各种过程中发挥着重要作用, 这些作用在许多方面影响人类的社会和经济发展[ 2]。微生物在土壤形成与发育、土壤结构与肥力以及高等植物生长等方面起着重要作用, 同时又以自己的生命活动产物进一步丰富土壤有机成分, 与土壤中的矿物质和有机质构成特殊的无机-有机-生物复合体, 对生态环境起着天然的过滤和净化作用, 成为维系土壤生态系统功能稳定的主导因子。同时, 地球陆地表层系统的许多重要过程都发生在土壤之中, 微生物不仅是土壤中物质形成与转化的关键动力, 也是联系土壤圈、大气圈、岩石圈、水圈和生物圈相互作用的纽带, 对全球物质循环和能量流动起着不可替代的作用, 被认为是地球元素生物地球化学循环的引擎[ 3]。事实上, 土壤中生活着与人类健康与经济发展相关的几乎所有微生物。但长期以来理论发展与技术手段的限制, 人类对土壤微生命资源的认识、发掘、调控和应用远远落后于生物科学的其他领域。
21世纪初, 通过对土壤微生物学基金申请的深入分析, 国家自然科学基金委地球科学部一处敏锐地意识到土壤微生物的分类出现了新理论、土壤微生物的原位表征技术逐渐成为可能, 土壤微生物学不仅获得了自身发展的重大契机, 也为我国农业生产实践、全球环境变化和生态环境安全等国家战略需求提供了新思路。据此, 国家自然科学基金委地球科学部一处特别关注并支持、资助了一批土壤微生物学及其相关的重大、重点和面上以及人才项目, 有力地推动了我国土壤微生物学及相关学科的人才培养、平台建设与成果产出, 促进了我国土壤微生物学科新兴生长点的快速发展。我们也欣喜地看到, 过去十年我国土壤微生物学凝聚了一批研究队伍, 土壤微生物学的学科体系渐趋完善, 在重点领域取得了关键突破。在技术发展日新月异的新形势下, 系统梳理我国土壤微生物学的十年研究, 有利于更加深刻理解土壤微生物的生物特性、功能差异以及区域结构的不同, 更加全面认识土壤物质循环特征、物质形态变化以及不同圈层的物质交换, 强化土壤微观过程机理研究的知识积累与理论创新能力。
土壤生物学性状(土壤微生物种群、群落结构及其功能群、微生物生物量、酶活性等)可以反映土壤质量、土壤肥力的演变, 并可用作评价土壤健康的生物指标[ 4]。土壤微生物对土壤肥力形成与演变的作用主要表现以下方面。首先, 生物是土壤形成的五大因素之一, 在土壤发生与演化过程中发挥着中用作用。在高等植物出现之前的土壤形成的初始阶段, 土壤微生物是土壤的早期定居的功能生物, 在土壤初始有机质形成与积累中发挥重要作用。此外, 土壤微生物参与次生矿物的形成, 以及铁、锰、铜、硫等元素的生物地球化学转化过程[ 5]。土壤矿物和微生物的相互作用可改变矿物和微生物体表面性质及生物活性, 进而影响土壤肥力等环境效应[ 6]。其次, 微生物活动强烈影响土壤物理结构的, 是土壤团聚体形成的重要驱动因素。土壤微生物的分泌物和分解产物, 以及在分解有机质过程中合成的结构复杂的产物是土壤矿物和团聚体的“粘合剂”, 促进土壤团聚体的形成和物理性状的发育[ 7, 8, 9]。此外, 土壤微生物被认为是有机质转化与养分元素循环的引擎。土壤中各种来源和形态的有机质最终都必须经过微生物的分解矿化过程从能重新进入土壤生物地球化学循环。微生物吸收和“临时”保持养分, 是植物的养分“有效库”。微生物能够通过分泌有机酸和功能酶的成分直接“活化”固定态的磷、钾等养分[ 10, 11]。解析土壤微生物参与的土壤肥力演变过程, 是深刻理解微生物功能与过程的重要突破口。
近100年来, 全球平均气温增加了0.74 °C, 变幅约为0.56~0.92 °C。预计到2100年, 根据温室气体的不同排放情景分析, 全球平均气温还将增加2~4 °C[ 12]。气候变化已经对自然生态系统和社会经济产生了显著影响, 并将在未来数十年乃至几个世纪继续对农业生产、海平面上升、水资源供需、人类健康等产生更加深刻的影响。我国于2006年发布了《气候变化国家评估报告》, 指出气候变化已经对中国产生了一定影响, 造成了沿海海平面上升、西北冰川面积减少、春季物候期提前, 并可能导致农业生产不稳定性增加、南方地区洪涝灾害加重、北方地区水资源供需矛盾加剧、森林和草原等生态系统退化、生物多样性锐减、台风和风暴频发等问题。我国人口众多、气候条件复杂、生态环境脆弱, 适应气候变化将面临巨大挑战。
国际社会已普遍接受IPCC第四次评估报告的结论, 即有很大可能性, 过去100年全球平均气温的增加主要是由人类排放温室气体引起的。据估计, 目前二氧化碳、甲烷、氧化亚氮这三类温室气体的浓度已分别比工业革命前增加了35%, 148%和18%[ 12], 是引发全球变暖的主要原因。甲烷和氧化亚氮不仅具有增温效应, 而且还是大气层最重要的化学活性物质, 目前氧化亚氮已成为破坏平流层臭氧最主要的痕量气体[ 13]。大气温室气体的动态变化与土壤生物过程紧密相关。据估计, 仅湿地和水稻田产甲烷菌引起的甲烷排放约占全球总排放量的三分之一[ 14], 而农田施肥相关过程所排放的氧化亚氮约占全球年排放总量的75%[ 12]。过去30多年来, 国内外学者对土壤温室气体排放通量和情景预测进行了大量研究, 但目前依然面临一些重大问题挑战:首先, 温室气体排放动态的模拟预测变异巨大[ 15], 仅陆地生态系统CO2收支平衡的预测变异就相当于化石燃烧CO2总排放量的6倍以上, 其预测不确定性的根本原因可追溯到对土壤微生物过程缺乏基本理解;其次, 尽管目前二氧化碳排放已成为国际社会对全球变化研究和政治谈判的焦点, 但甲烷和氧化亚氮浓度升高所导致的温室效应占到总增温效应的1/3[ 12], 这两种气体的排放动态几乎完全受土壤微生物过程控制, 目前国际上对这两种气体的过程机理理解尚非常欠缺。因此, 研究温室气体在土壤和生物圈的发生和消解机制, 提高大气层温室气体的动态模拟和预测准确性, 提出切实可行的减排策略和措施, 是目前土壤学、地学和全球变化科学领域面临的重要挑战和前沿方向。
随着工业化和城镇化的快速发展, 土壤污染问题日益突出。污染物进入土壤后经历物理、化学和生物学的作用, 发生迁移、形态转化和分解等过程, 最终影响污染物的生物效应和归趋。微生物在污染物的迁移转化过程中起着关键的作用。土壤中有些微生物携带一些功能基因(如双加氧酶基因等), 其表达的蛋白是降解有机污染物的关键酶。有效调控这些功能基因的表达可以达到有机污染物的生物降解和污染土壤的生物修复。有的微生物在长期进化过程中形成了以一些有机污染物为唯一碳源的生理代谢特点, 通过降解污染物获得能量进行生长繁殖[ 16, 17]。微生物还可以通过共代谢(或共氧化)的作用降解有机污染物[ 18]。微生物也可以控制重金属的氧化还原及其相应的形态转化。比较典型的例子是土壤中汞和砷的甲基化。汞从无机态转化为甲基汞需要在还原条件下厌氧微生物的参与。最近, 美国科学家在 Desulfovibrio desulfuricansND132 和 Geobacter sulfurreducensPCA.两个菌中发现了两个相关基因, 揭示了环境中甲基汞形成的分子机制[ 19]。土壤中微生物介导的甲基汞形成的分子机制目前还很少得到研究。除了甲基化, 微生物在金属的氧化还原过程中也发挥了关键的作用。例如, 通过添加食用油等电子供体可以促进微生物将六价的铀还原为四价, 加快沉淀, 达到修复的目的[ 20]。
在2005年国家自然科学基金委地球科学部组织召开的“土壤生物与土壤过程”研讨会精神的带动下, “十一五”以来国内主要土壤学研究单位抓住机遇, 在科学基金选题方面, 瞄准土壤生物学前沿问题, 提出了大量具有交叉性和前沿性的研究课题。开展了一系列的深入研究, 形成了一批具有战略眼光和国际研究水平的中青年学科带头人, 提高了我国土壤微物学研究的国际地位。
仅以地球科学部一处土壤生物学项目(申请代码D010504)统计, 对比2000—2004, 2005—2009以及2010—2013年3个时段, 资助经费分别为671, 3654和1 1695万元, 资助项目数分别为23项、102项、197项, 获资助依托单位数量分别为13个、47个、76个;2005—2013期间, 共计资助土壤生物学各类项目299项, 经费15349万元。其中资助面上项目、青年基金、地区基金项目共277项, 经费11539万元, 占75.2%;对比2005—2009年和2010—2013年 2个时段, 土壤生物学(D010504)项目申请量占土壤学(D0105)项目申请量的比例分别为16.7%和17.7%, 而其获资助项目所占比例分别为21.7%和20.4%, 获资助经费所占比例分别为20.8%和23.1%;1994—2013期间, 地球科学部一处(申请代码D01)共计资助杰出青年基金75人, 其中土壤学(申请代码D0105)23人, 占30.7%。土壤学中从事土壤生物学(申请代码D010504)研究5人, 从事土壤化学(申请代码D010503)和土壤生物学交叉研究的8人, 两者占土壤学杰出青年基金获得者56.5%;对比2000—2004, 2005—2009以及2010—2013年3个时段, 获得土壤生物学资助5项以上依托单位数量逐渐增多, 从没有依托单位获得5项以上资助到6个单位、10个单位获得基金资助。虽然这些依托单位占土壤生物学获资助单位数量的比例仅为13.2%, 但他们获得的资助项目数占相应时段土壤生物学资助项目总数的比例已增加到46.7%, 成为我国土壤生物学基础研究和人才培养的重要基地。这些单位包括中国科学院南京土壤研究所、中国科学院生态环境研究中心、南京农业大学、中国科学院东北地理与农业生态研究所、中国科学院亚热带农业生态研究所、中国农业大学、华中农业大学、华南农业大学、南京师范大学、广东省生态环境与土壤研究所。在2005—2013期间资助的土壤生物学相关重点项目、重大项目、杰出青年基金、优秀青年基金项目共计14项, 经费3748万元, 其中13项为上述单位承担。
过去10年, 我国土壤微生物学在研究方法方面取得了跨越式的发展, 已经形成了土壤微生物数量、组成与功能研究的基本技术体系;在研究内容方面以前所未有的广度和深度拓展, 超越了传统细菌、真菌和放线菌的表观认识, 围绕土壤生态系统的关键过程, 在有机质分解、土壤元素转化与土壤质量保育过程等方面系统研究了土壤微生物的群落结构及其功能, 取得了显著的进展;在土壤微生物学理论方面, 形成了较为完善的土壤微生物多样性、土壤微生物结构与功能等研究理念, 在土壤元素生物地球化学循环的微生物驱动机制等方面取得了重要进展, 成为我国土壤微生物学发展史上最值得浓墨重彩的一笔。
微生物是肉眼不可见微小生命体, 因此土壤微生物学的发展几乎完全依赖于方法的进步。分子技术则成为21世纪土壤微生物学发展的主要推动力。国家自然科学基金委地球科学部一处抓住土壤微生物及相关学科发展的良好契机, 资助了一系列重大、重点和面上研究及人才培养项目, 极大地促进了我国土壤微生物学的研究发展。2002年起, 以聚丙烯酰胺凝胶电泳DGGE为代表的分子指纹图谱技术引入了我国土壤微生物研究领域, 极大地推动了我国土壤微生物组成的研究。在土壤微生物数量分析方面, 实时荧光定量PCR技术得到广泛应用, 显著地推动了我国土壤微生物的定量化研究, 贺纪正研究员利用该技术探讨了土壤中硝化微生物数量变化规律, 研究成果得到国际同行的高度关注[ 21], 在我国2007年刊发的约14.8万论文中, 被引次数排名第134位。此外, 近年来稳定性同位素示踪和新一代高通量测序等先进技术已经或正在成为我国土壤微生物功能研究的常规手段, 这些最先进的技术大多出现于2005年以后, 在解决土壤微生物重大科学问题的下游应用方面, 我们与国际同行几乎处于同一起跑线, 在某些方面拥有部分领先的技术优势, 为我国土壤微生物学的进一步发展奠定了扎实的基础。
随着技术体系的不断成熟, 过去10年我国土壤微生物学的研究对象从单一的农田生态系统拓展到我国几乎所有的自然与人为陆地生态系统类型;研究内容从传统细菌、放线菌和真菌分类为基础的微生物区系调查及单纯的作物增产应用研究, 深入到土壤微生物在农业、环境和生态等领域重大问题的基础与应用基础研究, 特别围绕我国土壤微生物资源发掘、土壤环境污染、土壤养分转化与全球变化等重要问题, 将传统土壤微生物过程表观动力学的描述性研究, 推进到了分子、细胞、群落与生态系统等不同尺度下的多层次立体式系统认知水平, 在土壤微生物知识积累与理论凝练方面取得了重要进展, 初步厘清了土壤微生物多样性(物种数量与组成)及其功能(生理)的基本概念;建立了土壤微生物为基础的生物地球化学循环基本框架, 发展了土壤微生物地理分异规律的生态与进化研究理念, 为进一步阐明土壤微生物与环境相互作用机制, 准确认知土壤微生物多样性的维持机制及其驱动力, 提升我国土壤微生物学理论创新能力奠定了坚实的基础。
土壤氮素转化完全依赖于微生物过程。过去10年, 我国土壤氨氧化、反硝化和厌氧铵氧化过程的微生物机理研究成绩斐然。我国在氨氧化微生物多样性及其作用机理的研究基本与国际同步, 2007年贺纪正等首次报道我国酸性红壤中古菌是数量上占优势的硝化微生物, 且与土壤硝化潜势具有显著正相关关系[ 21]。随后通过大量分子生态学调查, 逐步明确了氨氧化古菌(AOA)和氨氧化细菌(AOB)在各类土壤环境中的多样性分布特征及驱动其群落结构变化的主要因子, 发现并证实了AOA在酸性土壤硝化作用中的主导贡献。魏文学实验室较为系统地研究了我国稻田土壤反硝化过程不同步骤的关键功能基因( narG, napA, nirK, nirS, norB和 nosZ)的数量、组成及其相互关系, 初步揭示了其对稻田土壤反硝化过程与环境条件的响应机制[ 22, 23]。特别是最近几年, 祝贵兵等在稻田土壤生态系统中首次报道了厌氧铵氧化过程, 并在白洋淀湖泊岸边土壤中发现了厌氧铵氧化反应的热点微区[ 24, 25]。这些研究成果得到了国内外同行的广泛关注。
首先, 明确了AOA和AOB的分布特征及其主要驱动因子。不同的施肥处理、土地利用方式、土壤类型等都会影响AOA和AOB的组成及丰度。如在湖南酸性红壤中, 长期施氮处理显著降低AOA和AOB的数量, 且对AOA的群落组成有显著影响, 但对AOB的群落影响不显著[ 21]。同样是在酸性红壤中, 不同土地利用方式(包括恢复区、退化区、农作区和马尾松区处理)对AOA和AOB的数量和群落结构组成都产生了明显的影响, 尤其是退化区与其他利用方式的差异最为显著[ 26]。在河南碱性潮土中, 不同施肥处理引起AOB群落组成和丰度的显著变化, 而对AOA没有明显影响[ 27]。对我国不同土壤中氨氧化微生物多样性数据的整合分析和大范围土壤(65个样品)高通量测序研究表明, 土壤pH是影响AOA和AOB分布的主要驱动因子[ 28]。这为进一步认识这两类微生物的生理生态特征及功能活性提供了重要线索。
其次, 发现氨氧化古菌主导酸性土壤硝化过程。分子生态学与高通量测序表明AOA和AOB具有显著不同的生态位, 共同主导了土壤硝化过程。利用稳定性同位素13C示踪复杂土壤中硝化微生物核酸DNA技术(SIP)[ 29], 结合分子生物学分析, 发现在低氮及强酸性环境中, AOA是土壤硝化过程的主要驱动者[ 30, 31]。长期的酸性胁迫条件下, 古菌可能发展了基于脲酶水解过程的氨氧化过程[ 32], 而在碱性或高氮土壤中则相反, 硝化作用由AOB主导[ 27, 33, 34]。这些研究均证实了AOA和AOB的生态位分异特征, 即在高氮投入的pH中性和碱性的环境中, AOB是硝化作用的主要驱动者, 而AOA主要在较苛刻的环境包括低氮、强酸性和高温的环境中发挥功能[ 35]。
第三, 发现了水稻土等湿地土壤中的厌氧铵氧化反应。自然界的厌氧铵氧化反应于2003年发现于黑海和加勒比海, 并被《自然》杂志刊发[36] 37];随后发现厌氧铵氧化过程广泛存在于海洋环境, 可能是海洋氮损失的主要途径。但是在陆地生态系统, 厌氧铵氧化对氮转化的贡献尚不明确。祝贵兵等在稻田土壤生态系统中首次报道了厌氧铵氧化微生物过程[ 24], 发现在典型高氮施肥的稻田土壤中存在大量的厌氧铵氧化菌, 并导致厌氧铵氧化氮素损失占总氮量的4%~37%, 首次在原位土壤生态系统报道厌氧铵氧化反应的发生、活性及其生态功能[ 24]。该团队进一步利用15N示踪法精确测定厌氧铵氧化反应的活性及其贡献率, 在白洋淀湖泊岸边土壤中发现厌氧铵氧化反应的热点微区, 且得到的厌氧氨氧化活性和丰度值均高于已有的报道;另外还发现, 厌氧铵氧化反应热区能够减少N2O的释放, 该成果被《自然-地球科学》报道[ 25], 同时为认识厌氧铵氧化反应对土壤生态系统氮转化的贡献提供了重要依据。
水稻是我国最主要的粮食作物, 年生产量世界第一, 而总栽培面积仅次于印度为世界第二。但水稻农业同时也是甲烷温室气体的重要排放源, 在全球碳循环中占有重要地位, 因此水稻农业的可持续发展涉及粮食和环境安全两个重大问题。
近10年来, 通过运用分子生物学和稳定性同位素示踪技术相结合的新一代土壤微生物研究方法, 我国学者系统研究了水稻土植物残体降解过程中微生物的群落结构, 取得一系列重要研究进展。如中国农业大学陆雅海研究小组围绕水稻土有机质分解、甲烷产生和氧化的微生物机制问题, 做出了系统性和原创性工作, 取得的成果包括:①揭示了厌氧古菌和细菌在有机质降解过程中的演替规律, 发现不同土壤微生物特有的生存和适应策略在群落结构演替中的决定作用[ 38, 39];②阐明了有机质降解过程中间代谢产物互营分解的机理, 揭示了参与乙酸、丙酸和丁酸互营降解的关键细菌和古菌类型, 发现了互营降解细菌和古菌的专一性协作关系, 揭示了环境温度的重要调控作用[ 40, 41, 42];③揭示了水稻土厌氧产甲烷古菌群落对土壤干湿交替、氧气和硝酸盐胁迫的响应机制, 发现氧和硝酸盐对产甲烷古菌的调控作用主要发生在功能基因的转录水平[ 43, 44, 45];④研究了甲烷氧化菌在土壤剖面的分布特征, 分析了水稻品种对甲烷氧化菌的调控作用并原位研究了水稻根际和根表甲烷氧化菌的结构和功能。阐明了干湿交替过程导致土壤氧化还原过程变化并促进甲烷氧化过程的机制[ 46, 47, 48, 49, 50]。另外, 该研究小组通过多年努力成功分离到1株水稻土中起关键作用的新型产甲烷古菌(命名为产甲烷单胞菌HZ254菌株), 并对其生理生化、基因组和生态特征进行了表征, 揭示了该古菌不同寻常的抗氧机制[ 51, 52]。这些研究成果为促进水稻土有机残体管理水平、发展稻田甲烷减排技术提供了理论基础。这些创新成果已引起国际学术界的广泛关注。
土壤有机质的周转过程是一个十分复杂的物质流通和转化动力学过程, 对土壤各种物理、化学和生物学性质和过程具有深刻的影响, 与农田土壤肥力具有密切的关系。近10年来, 我国有机质周转与土壤肥力变化研究取得了重要进展。
首先, 农田土壤有机碳氮转化动力学特征。土壤微生物生物量测定方法对于从整体上研究土壤有机质转化和养分元素循环的微生物机理具有重要的意义。吴金水等[ 53]中国学者在基于氯仿熏蒸-提取过程的土壤微生物生物量系列测定方法的建立方面作出了关键贡献。2011年土壤学国际著名期刊《土壤生物与生物化学》在其“引用经典”栏目发表了主编观点, 专门评述了吴金水等[ 53]建立的土壤微生物生物量碳测定方法, 认为该方法是土壤微生物生物量测定的“黄金标准”, 是支撑现有众多在土壤微生物这个已经透明的“大黑匣子”里探索土壤微生物量这个小“黑匣子”秘密的方法基础, 即使20年过去了, 该经典论文仍有每年近50次的高引用率[ 54]。在此基础上, 我国学者建立了土壤微生物生物量碳周转速率测定方法、土壤释放CO2-C的微生物与非微生物来源比例测定方法[ 55]。这些方法的建立, 标志着土壤微生物量研究从定性到定量的跨越, 显著推动了我国土壤微生物总体生物量(碳)和养分储量及其周转研究, 以及土壤有机质和氮、磷、硫的微生物转化动力学研究[ 56, 57], 此外, 土壤有效氮素过渡库的理念[ 58]的提出, 为土壤氮素转化调控以及氮肥的高效利用研究和实践提供了新思路, 从而使我国在这些方面的研究发挥了引领作用。
其次, 土壤有机碳空间分布特征以及积累的生物化学特性。李勇等应用生态化学计量学的原理和方法, 从区域景观单元上, 量化了土壤微生物生物量(C, Ẽ, P)与C, Ẽ, P元素的生态化学计量关系, 提出亚热带景观尺度土壤微生物C:P受土壤C:P比控制的观点[ 59]。同时, 我国学者揭示了稻田土壤有机碳长期演变与水稻生产力的关系[ 60, 61, 62]、水稻光合同化碳的土壤传输和转化及其对氮肥施用的响应, 较高的施N水平明显促进水稻新鲜根际碳的沉积, 并显著影响土壤微生物量碳的更新率, 而对土壤可溶性有机碳更新率的影响较小[ 63]。此外, 吴金水等揭示了稻田土壤有机碳积累的特殊生物化学特性[ 64], 发现稻田土壤的微生物生物量及微生物周转速率尽管大于旱作土壤, 但外源添加有机底物条件下的矿化率却明显较低, 且并未产生明显的激发效应, 而旱地土壤的激发效应极为显著。
第三, 土壤微生物的碳同化潜力及其生态功能。率先发现土壤光合微生物对大气CO2具有明显的同化能力(相当于4.9~37.5 g C/(m﹒a))[ 65, 66], 这在一定程度上为寻找迷失的碳汇提供了可能的线索。解析了碳同化光合微生物的主要种类, 农田土壤中参与固碳的细菌类群为红细菌, 红环菌, 红假单胞菌、慢生根瘤菌、硝化细菌、硫氧化细菌、产碱杆菌等。此外, 固碳藻类微生物主要属于黄藻门和硅藻门藻类, 并克隆出其关键功能基因, 揭示了土壤微生物光合固碳在陆地生态系统碳同化过程中的重要作用。该发现改变了长期以来土壤微生物在陆地生态系统碳循环中仅担负有机质分解、矿化功能的认识, 扩大和丰富了陆地生态系统碳循环过程与土壤微生物的功能认识。进一步通过大量历史资料和长期定位试验的研究, 基本明确了我国农田土壤有机碳近40年来的演变态势[ 67, 68, 69, 70], 从区域景观单元尺度证实了我国亚热带稻田的明显固碳效应[ 62], 并阐明了亚热带稻田有利于有机碳积累和维持持续生产力的特殊的生物地球化学机理[ 64, 66, 71, 72]。
上述系列进展推动了我们对土壤有机质周转及其生物学过程与土壤肥力关系的深入认识, 对于提升农田土壤有机质水平、促进农田生产力持续与生态环境协调发展以及缓解全球气候变化具有重要作用。但现有的研究在广度和深度上都不能满足农田生态系统过程(主要是C, N, P等)与土壤肥力及生态环境功能形成机制的理论认识的需要。
根际是直接受植物根系和分泌物影响的土壤区域, 是土壤微生物作用于植物的重要场所[ 73]。根际包括了3个部分:根内、根表和外根际[ 74]。根际土壤微生物对植物的生长和健康发挥着重要作用[ 74, 75, 76], 根际微生物能够活化根际养分和促进植物根系吸收养分[ 77], 也能提高植物的免疫力以抵抗生物和非生物的胁迫[ 78];另一方面, 植物通过根系分泌物为根际微生物提供养分, 根系分泌物中的某些组分还能作为信号分子调控根际微生物的行为[ 79]。
根际微生物研究的最终目标是充分利用根际微生物资源, 促进植物生长、保持植物健康、减少农用化学品的投入, 从而促进农业可持续发展。传统上, 我国根际微生物研究主要是围绕有益微生物资源(植物根际共生和非共生)收集、根际土壤接种应用等进行了大量研究工作。近年来, 随着分子生物学和组学技术的发展, 围绕着调控根际微生物促进植物生长和保持植物健康, 在增强有益菌根际定殖、调控根际微生物群落结构、培育高生物肥力及抑病型土壤微生物区系等基础科学问题方面开展了研究。
对人工接种的根际有益菌, 在根际的有效定殖是其充分发挥功能的前提, 对这一根际定殖过程及调控机理的研究至关重要。国内学者以解淀粉芽孢杆菌为材料, 证明了全局性调控因子AbrB, DegU, SinR及代谢产物均能调控有益菌的根际定殖[ 80, 81], 也发现植物根系分泌的小分子有机酸可以促进特定有益菌的根际定殖[ 82]。
虽然单个根际有益微生物对植物非常重要, 但根际微生物群体对宿主植物发挥着更为重要的作用。植物通过根系分泌物等形成了自己特有的根际微生物群落结构, 也被称为植物的第二个基因组。因此, 从根际微生物区系的水平上, 研究整个植物根际的微生物群体组成特征, 以及如何通过农业措施调控整个根际微生物群落, 使其更利于宿主植物的生长等, 是近几年植物根际微生物研究的重点方向[ 76]。新一代高通量测序技术的发展, 使植物根际微生物区系的研究进展迅速。模式植物拟南芥及典型抑病型土壤的根际微生物区系的组成是这两年报道较多的研究领域[ 83, 84, 85]。国内学者除了及时采用新方法应用于我国植物根际微生物区系研究之外, 结合我国特有的集约化管理模式, 开展了构建和调控高生物肥力及抑病型根际土壤微生物区系工作。利用外源有益微生物与有机肥通过二次固体发酵制成的微生物有机肥, 在调控根际微生物区系、促进植物生长和健康的研究方面取得了显著成果[ 86, 87, 88], 受到国际同行的重视。
生活在土壤中的微生物, 80%~90%是粘附在各种矿物或矿物-有机物复合体表面, 形成微菌落或生物膜。土壤矿物不仅仅是支撑微生物生长的惰性载体, 其组成和性质更是决定土壤微生物的群落结构、多样性及活性的重要因素之一。另一方面, 土壤微生物直接或间接参与了土壤中各种矿物的风化和演变, 控制着土壤发育的程度。土壤微生物与矿物的相互作用深刻影响着一系列的土壤过程, 如矿物形成演化、土壤结构稳定性、土壤病原菌传播、土壤养分及污染物形态和有效性等。
近10年来, 我国学者围绕矿物-微生物互作研究技术、界面过程、影响因素及环境效应等方面开展了富有成效的工作, 总体处于国际先进行列, 在某些方面引领着该领域的研究。
1)基本摸清了不同类型土壤黏粒矿物、土壤颗粒对代表性细菌吸附量的差异及其影响因素, 初步阐明了矿物与细菌界面的作用力及相关机制。荣兴民等[ 89]报道, 在高岭石和蒙脱石表面对假单胞菌( Pseudomonas putida)和芽孢杆菌( Bacillus subtilis)的吸附过程中, 疏水作用比静电作用的贡献更大。Hong等[ 90]对6种原生和次生矿物吸附枯草芽孢杆菌( B. subtilis)的系统研究表明, 吸附量和亲和力与矿物外比表面积成线性正相关, 与扩展DLVO理论预测的静电能障成线性负相关。矿物与微生物的相互作用可能借助于微生物表面的分子识别机制, 黏粒对胞外聚合物(EPS)中含N组分的选择性更强, 而粉粒和砂粒则优先吸附EPS-C组分, 层状硅酸盐黏粒矿物优先吸附含蛋白质的EPS组分, 而针铁矿与EPS中的核酸组分的亲和力更强[ 91, 92]。
(2)揭示了环境要素影响矿物-微生物互作的规律及其机制。一般而言, 黏粒矿物和土壤颗粒对假单胞菌( P. putida)的吸附量均随pH值的下降而显著增加[ 93, 94, 95]。体系中阳离子的存在能促进矿物对细菌的吸附, 且二价离子的促进作用比一价离子更强[ 93]。低分子量有机配体和无机配体如柠檬酸盐、酒石酸盐、草酸盐和磷酸盐显著抑制高岭石、蒙脱石和针铁矿对假单胞菌( P. putida)和芽孢杆菌( Bacillus thuringiensis)的吸附, 这种抑制作用似乎与有机分子的分子量及羟基数量呈正相关[ 96, 97]。
(3)较早将微量热技术用于土壤组分与微生物的界面互作研究。在研究方法上, 除经典化学吸附、模型模拟、红外、电镜等外, 一些新的技术方法逐步引入细菌与矿物的互作研究, 如采用微量热技术发现高岭石、蒙脱石和针铁矿与枯草芽孢杆菌( B. subtilis)间的结合是一个放热过程[ 98], 且这3种矿物可促进苏云金芽孢杆菌( B. thuringiensis)对数期生长, 而抑制其孢子形成[ 99]。Fang等[ 92]利用同步辐射技术获得了细菌胞外聚合物与针铁矿的相互作用的分子机制, 体系pH由低到高时(3~9), 吸附产物构型由单基配位向双基配位过渡。最近, Cai等[ 100]首次引入平行板流动系统, 研究了流动状态下病原菌在土壤矿物表面运移、粘附和存活过程, 实现了互作界面过程的实时定量研究。
(4)阐明了微生物-矿物互作影响污染物降解与转化的内在机理。矿物-微生物互作深刻影响着污染物的化学行为与有效性, 研究表明, 降解有机污染物的细菌, 在游离状态下与被不同类型黏粒矿物固定有着显著不同的降解活性, 针铁矿显示对西维因降解菌的高亲和力, 显著抑制降解菌的活性, 导致体系对西维因的降解效率较低[ 101]。对重金属而言, 细菌与蒙脱石复合后, 吸附量增加16~30%, 而与针铁矿复合后, 则导致体系吸附量的下降, 意味着蒙脱石-细菌间松散的结合增加了复合体的吸附位点, 而针铁矿—细菌间紧密的结合可能屏蔽了部分反应位点[ 102, 103]。
外源污染物进入土壤后, 在土壤生物的作用下发生形态转化和降解, 改变污染物的移动性、毒性和最终归趋。涉及生物转化的污染物很多, 我国关于土壤中污染物生物转化的研究涵盖的内容也很多, 在此仅以典型案例作简要论述。近年来我国学者在土壤中金属元素(汞、砷等)的生物转化及其健康效应方面取得了大量有影响的研究成果。研究发现在我国内陆汞污染地区水稻是居民甲基汞主要来源, 对人体健康构成潜在危害, 而甲基汞可能主要来自于水稻土淹水条件下微生物对汞的甲基化作用[ 104]。与汞相反, 砷的甲基化可降低其毒性, 并通过形成三甲基砷而进行挥发, 是砷污染土壤和水体的潜在生物修复途径[ 105]。中科院的相关研究团队围绕土壤, 特别是水稻土中砷的生物转化开展了系统的研究工作, 在本领域的主流刊物发表了系列论文。朱永官小组在国际上较早开展微生物砷甲基化分子机制的研究, 他们首次从光合生物-蓝藻中克隆和表征了砷甲基化的功能基因-甲基转移酶基因[ 106]。通过设计通用引物, Jia等成功地从土壤中克隆到砷甲基转移酶基因, 发现该基因在土壤中广泛存在。进一步研究发现水稻土中甲基转移酶基因的丰度与甲基砷含量呈显著正相关[ 107]。这项研究发表后即被推荐入选Faculty of 1000, 产生了重要的国际影响。砷甲基化与土壤有机质和有机肥施用直接相关, 研究表明土壤添加具有强还原性的有机质可以增加砷的生物有效性, 促进土壤中砷的挥发, 且水稻甲基砷来自土壤微生物的作用[ 108, 109]。土壤添加有机质也促进水稻籽粒中砷的积累, 特别是甲基砷的积累, 因此对于砷污染的土壤需要慎用有机肥[ 110]。现有研究证明植物不具有甲基化砷的能力, 但可吸收外源甲基砷[ 111]。水稻可以通过吸收来自土壤的甲基砷而挥发砷, 但是量非常小[ 109]。朱永官的实验室成功地将微生物砷甲基转移酶基因表达到水稻可以使其形成甲基砷并挥发砷, 在国际上首次实现高等植物对砷的挥发[ 112]。
除了金属污染物的生物转化研究, 我国学者在土壤中有机污染物的生物转化方面也开展了大量研究工作。朱永官实验室在多环芳烃污染土壤的根际修复和微生物功能基因表达等方面开展了系统的工作。他们发现根系分泌物通过调控多环芳烃降解微生物群落和改善多环芳烃生物有效性来提高降解, 促进根际修复效率[ 113]。采用基于13C标记的SIP技术(Stable isotope probing), Peng等揭示在堆肥过程中降解土壤多环芳烃的主要微生物种群变化的动态特征, 为提高生物吸附效率提供了理论依据[ 114]。发掘高效降解高分子量PAHs 的生物资源成为生物修复的关键, 骆永明研究员课题组分离到一株能以苯并[a]芘(B[a]P)为唯一碳源和能源生长的噬氨副球菌HPD-2( Paracoccus aminovorans HPD-2), 为高分子量PAHs污染土壤的生物修复提供了宝贵的微生物资源;深入研究了噬氨副球菌HPD-2对B[a]P的降解特性, 发现该菌株在3.0 mg L-1的B[a]P液体培养基中培养5d后B[a]P的降解率高达89.7%。经衍生化后GC-MS鉴定结果发现, 8-羧酸-7-羟基芘和双羟基菲为噬氨副球菌HPD-2降解B[a]P的两种主要代谢中间产物, 并推断了该菌降解B[a]P的可能途径[ 115]。
土壤生物污染是指对人类和土壤生态系统具有潜在危害的外来生物物种入侵现象。通常情况下, 这些外源生物种群生长迅速, 极易破坏土壤生态系统的原有平衡, 如植物病原菌在土壤中的行为和归趋已有大量报道。此外, 病原菌和抗生素抗性基因在土壤中的广泛传播, 对人类健康和生态安全带来巨大隐患, 得到了学术界和各国政府的高度关注[ 116]。近年来我国在土壤中病毒和病原细菌的传输和存活以及抗性基因方面开展了大量的研究, 在此简要介绍。
中国科学院南京土壤研究所赵炳梓实验室重点研究了微生物与土壤矿物相互作用规律。赵炳梓等发现砂质潮土对病毒的吸附能力很弱, 土壤灭菌对病毒消亡影响很小;但红壤的研究结果明显不同, 灭菌处理显著增加病毒在红壤上的吸附和消亡, 并且随着土壤含水量的降低其消亡行为加剧[ 117, 118]。换言之, 土壤含水量和土壤灭菌对病毒的消亡有叠加作用, 其主要原因可能是红壤的铁铝氧化物含量高、pH低, 病毒在固-液界面的作用加强极易导致叠加作用。此外, 灭菌导致红壤对病毒吸附增强的原因可能是由于增加病毒消亡所致。因而, 土壤土著微生物和土壤含水量对病毒消亡的影响依土壤本身性质不同而异, 其对消亡的影响程度可能主要受制于土壤中金属氧化物的含量[ 118]。徐建明实验室围绕环境中大肠杆菌 Escherichia coliO157:H7存活及其影响因素, 发现露天蔬菜土壤中O157:H7衰减的速率最快, 1, 4, 7, 10, 15年大棚设施年限的蔬菜土壤中O157:H7衰减的速率随设施年限增长而降低[ 119]。这表明, 随大棚设施年限增长, 蔬菜土壤中O157:H7存活时间将有所延长, 也即O157:H7污染风险将增大。土壤微生物的磷脂脂肪酸分子标靶PLFAs分析结果表明, 土著微生物与 O157:H7存活间存在交互关系。土壤中O157:H7存活时间与土壤细菌和真菌的PLFAs比值呈负相关, 其中革兰氏阴性菌对O157:H7存活的抑制作用最为突出。进一步的研究则表明土壤中O157:H7对环境产生的危害不仅仅是O157:H7对人体的致病性, 而且还有其对土壤微生物环境的影响和干扰[ 119]。
抗生素的广泛使用在生物体内产生了大量抗性基因并在土壤中的富集和传播, 成为土壤生物污染的新问题, 可能对公众健康产生严重危害, 得到了世界各国政府的高度重视。朱永官实验室从我国3个城郊大型养猪场及周边地区分别采集了猪粪、猪粪堆肥和施用堆肥的土壤样品, 采用了高通量的基因定量技术对环境样品中的244种抗性基因进行了检测和定量分析。结果表明这些样品中含有149种抗生素抗性基因, 这些抗性基因涵盖了目前已知的主要抗性类型, 其中有63种抗性基因丰度显著高于没有施用抗生素的对照样品中(192~21600倍)[ 116]。转座酶基因丰度最高可达对照样品的90000倍, 而且与抗生素抗性基因的浓度成显著正相关, 暗示转座酶是引起抗性基因富集的原因之一。这些结果表明过度的抗生素使用可引起抗生素抗性基因的富集, 并可通过动物粪便排放到环境中。高丰度的转座酶可能使得这些抗性基因转移到人类致病菌中, 危害人类健康。研究进一步发现, 抗性基因的丰度与环境中抗生素和砷铜等重金属浓度显著正相关, 表明砷铜等重金属和抗生素的复合污染可能增加环境中抗性基因的丰度。这一成果为有效控制抗生素抗性基因的蔓延, 加强集约化养殖业中饲料添加剂的管理, 优化兽用抗生素的使用提供了重要思路;为我国政府制定合理的抗生素管理政策提供了依据。
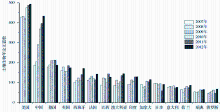
过去10年, 我国土壤微生物学研究快速发展, 2007年以来我国 SCI发文量超越德国并持续快速增加, 目前仅次于美国居世界第二。如图1所示, 针对科学引文索引SCI-E数据库, 采用标题、主题、出版物名称等对2007-2012年世界各国土壤生物SCI发文量进行检索, 共获得到13544篇研究论文, 这些论文由135个国家(地区)的5734个机构完成, 涉及科研人员4万左右。统计分析表明, 世界土壤生物学研究呈现出明显的两极分化现象。美国等11个发达国家和中国及4个金砖四国共计发表论文13090篇, 占这一时段世界论文总量的96.6%, 其中美国、中国和德国分别为20.2%, 13.9%和8.79%。同时, 近6年SCI发文量的趋势分析表明, 2010年之前美国土壤生物学研究在世界范围内一枝独秀;2010年后, 我国土壤生物学发文量逐渐接近美国, 与其它国家的比较优势地位益发突出。进一步的分析表明, 发文量位居世界前15位的研究结构中, 中美各占三席、瑞典次之, 而其它7个国家各有一个研究结构入选(图2)。中国科学院在世界土壤生物学研究结构中处于明显的领先地位, 2007—2012年SCI发文量远高于排名第2的美国农业部, 分别为819篇和289篇(图2)。过去6年发文量的趋势分析则表明, 世界其它研究机构的发文量停滞不前或增加趋势不明显, 与中国科学院存在至少2.8倍以上的差距, 短期内难以望其项背。
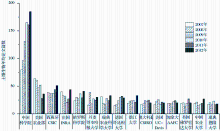 | 图2 2007—2012年土壤生物研究SCI发文量的前15位研究结构及其变化规律论文检索策略与图1相同。图中英文缩写含义如下, CSIC:西班牙国家研究委员会;INRA:法国农业科学研究院;CSIRO:澳大利亚联邦 科学与工业研究组织;UC-Davis:美国加州大学戴维斯分校;AAFC:加拿大农业及农业食品部Fig.2 The numbers of science citation indexed papers in soil biology discipline from top 15 institutions during 2007-2012 |
随着SCI发文量的快速增加, 我国土壤生物学高水平研究产出增长势头明显。通过对土壤生物学进行主题分析, 特别围绕土壤过程与土壤生物作用统计检索, 如表1所示, 在2000—2012时段土壤微生物学SCI论文中, 我国发表论文大于20篇以上的作者共计11位。这11位作者贡献了这一时段我国土壤微生物学论文总量的8.98%、论文总被引次数的15.2%。同时, 对这些作者各自发表论文数最多的前三位刊物进行分析, 发现共计156篇论文发表在23种不同的SCI刊物, 32%强的论文刊发于影响因子大于3.0的刊物, 其中将近一半的论文发表于微生物学领域主流 Applied Environmental Microbiology和土壤微生物学权威刊物 Soil Biology and Biochemistry等杂志, 表明我国土壤微生物学及相关研究工作得到了国际同行的高度认可。此外, 这些作者承担了基金委土壤微生物学及其相关领域的73个项目, 其中重大、重点、杰出青年和国际合作项目高达52项, 占所有项目的71%, 表明基金委有限目标、重点突破的战略思想在我国土壤微生物学优秀人才培养和重大成果产出方面发挥了极为重要的作用。例如, 其中一些青年人才已在国际舞台崭露头角, 成为各自领域的优秀学术带头人, 在国际科学组织和学术团体担任了重要职务。如朱永官研究员担任了国际原子能机构科学委员会委员(2004—2012);黄巧云教授现任环境生物地球化学学会(ISEB)国际学术委员会执委、曾任第4届土壤矿物-有机物-微生物相互作用国际学术研讨会主席(2004年)和第21届环境生物地球化学国际学术研讨会主席(2013年)等。同时, 一批青年科研人员在土壤微生物学及相关领域国际著名刊物担任了领域编委, 如 Applied and Environmental Microbiology, FEMS Microbiology Ecology, New Phytologist; Biogeosciences和 Applied Soil Ecology等。
我国学者在土壤生物学方面的研究成果得到国际同行的好评。在土壤氮素转化研究方面, 贺纪正等敏锐地把握住国际前沿, 在国际上率先研究了酸性土壤氨氧化古菌多样性及其功能, 是土壤氨氧化古菌研究最早的三项开拓性工作之一[ 21, 120, 121], 研究成果曾被自然-中国作为亮点推荐, 作为古菌可能主导酸性土壤氨氧化的依据被广泛引用, 迄今高达204次;张丽梅等利用稳定性同位素核酸探针技术揭示了土壤古菌的氨氧化活性及化能无机自养代谢特点[ 122], 被国际同行认为是国际首次, 并在微生物学著名刊物重点评述[ 123];我国研究人员进一步发现了基于脲酶水解的土壤古菌氨氧化生理特征[ 32], 这一成果作为古菌生态学意义的典范性事例, 被三域理论创始人Carl Woese的追忆论文正面评价[ 124]。在土壤微生物与肥力方面, 吴金水等建立了土壤微生物生物量测定方法[ 125], 规范了土壤有机质转化与养分元素循环的微生物过程研究, 被国际著名土壤生物化学家Brookes教授认为是土壤生物化学研究的重要贡献, 并被同行在国际著名刊物《自然综述——微生物》刊文高度评价[ 126]。林先贵等[ 127]利用稳定性同位素13C-示踪技术, 揭示了土壤养分元素由低等光合微生物向高等原生生物转移的食物网模式, 被国际同行认为是土壤生产力持续发展微生物机理研究的重要进展[ 128];进一步发现稻田土壤梭菌可利用甲酸作为电子供体促进水稻土硫酸盐与铁还原过程[ 129], 被美国农学会新闻月刊作为研究亮点专刊评述。朱永官实验室有关土壤抗生素抗性基因的论文在 Environmental Science & Technology和PNAS发表后均成为刊物的亮点论文, 有关利用高通量PCR技术获得的研究得到美国时代周刊等报道。
过去10年, 我国土壤微生物学研究跨越式的发展取决于以下两点。首先, 我国土壤微生物学科研投入快速增加, 与发达国家的差距迅速缩小;其次, 土壤微生物的分类理论逐渐得到学术界广泛认可。20世纪末期, Carl Woese提出的三域理论根本改变了微生物学和进化等学科的基本理论框架, 使得海量的土壤微生物多样性研究得以规范化, 国家自然科学基金委地球部一处和国家相关部门及时把握住了这一战略发展机遇期, 积极引领并指导了我国土壤微生物学的快速发展。然而, 我们也必须清楚认识到我国土壤生物学的整体研究水平与国际前沿仍有明显差距。SCI论文引用次数常被学术界作为研究水平和影响力的重要指标。利用关键词“Soil”和“microbial OR bacteria OR fungi OR fauna”进行SCI-E主题检索, 通过限定作者单位为中国(大陆和香港), 或者不限定单位(世界)对比我国与世界SCI发文与被引状况。如表2所示, 过
| 表1 自2000-2012年土壤微生物学SCI发文量大于20篇的国内主要作者及国家基金委资助项目概况 Table 1 Overview of the authors with science citation indexed paper more than 20 in soil microbiology discipline and their research funds from the National Natural Science Foundation during 2000-2012 |
| 表2 2000—2012年不同时段我国与世界土壤生物学SCI论文发表与引用对比* Table 2 Comparison of publication number and citation index in soil microbiology discipline between Chinese and foreign scientists during 2000-2012 |
去13年来, 我国单篇论文年均引用次数仅相当于世界平均水平的47.4%, 单篇论文平均影响力进步不明显。如2000年以来3个不同时段我国SCI论文被引总次数占世界比例分别为1.72%, 7.08%和11.3%, 同一时期, 我国土壤生物学论文产出占世界比例分别为2.76%(世界第16位), 9.35%(仅次于美国和德国居世界第三)和15.7%(仅次于美国20.4%而居世界第2位), 被引用总次数的增加明显落后于年均论文篇数的增加, 导致单篇论文平均引用次数低于世界平均水平。此外, 在发文量排名前10位的国家中, 我国被引频次≥50的论文比例排名第7, 仅高于西班牙、巴西和印度;我国学者在 Environmental Microbiology, Applied and Environmental Microbiology, The ISME Journal和 Soil Biology and Biochemistry等土壤微生物学主流刊物发表的论文数量仍然较少, 未能进入世界前十位, 特别在土壤生物学主流刊物 Soil Biology and Biochemistry发文的比例出现下降趋势, 从2005—2009年的4.8%降到2010—2012年的2.3%, 表明我国高水平的研究产出仍待加强。
回顾我国土壤微生物学的发展, 过去10年无疑是最值得浓墨重彩的黄金时期。我国土壤微生物学论文数量及其占世界的比例实现了跨越式的发展, 论文增幅最高可达10倍(表2), 逐渐接近金字塔顶尖的美国土壤微生物学研究(图1)。然而, 传统的微生物多样性描述性研究已臻成熟, 我国土壤微生物学面临着从数量向质量转变的历史机遇和挑战。地球表层系统的几乎每一个过程都是物理、化学和生物相互作用的集中体现, 并以土壤的内部过程最为典型。每一克土壤中凝聚了从纳米级别的化学元素, 到微米级别的微小生物, 再到毫米和厘米级别的团聚体物理结构, 是地球生态系统中物理、化学和生物相互作用最复杂、最典型的研究体系。在新技术发展日新月异的国际环境下, 通过整合不同学科优势力量, 强化不同学科交叉研究, 发挥建制化的集成攻关优势, 破译土壤生物、物理和化学的机制及其对土壤过程的影响, 将为解析陆地表层系统变化提供重要理论基础, 在新的起点上再次实现我国土壤微生物学的跨越式发展。
致谢:本文构思和部分材料来自国家基金委地球科学一处2005年组织举办的“土壤生物与土壤过程”学术研讨会。作者感谢参加研讨会的各位专家和同事;感谢在国家基金委土壤生物战略规划过程中提供资料的各位专家;感谢在论文写作过程中参与讨论并给予宝贵建议的专家和同事;感谢中国科学院城市环境研究所姚槐应研究员、中国科学院资源环境科学信息中心王雪梅副研究员提供的科学引文检索数据。由于时间和作者能力的局限, 如有疏漏请读者谅解。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
|
| [86] |
|
| [87] |
|
| [88] |
|
| [89] |
|
| [90] |
|
| [91] |
|
| [92] |
|
| [93] |
|
| [94] |
|
| [95] |
|
| [96] |
|
| [97] |
|
| [98] |
|
| [99] |
|
| 100 |
|
| 101 |
|
| 102 |
|
| 103 |
|
| 104 |
|
| 105 |
|
| 106 |
|
| 107 |
|
| 108 |
|
| 109 |
|
| 110 |
|
| 111 |
|
| 112 |
|
| 113 |
|
| 114 |
|
| 115 |
|
| 116 |
|
| 117 |
|
| 118 |
|
| 119 |
|
| 120 |
|
| 121 |
|
| 122 |
|
| 123 |
|
| 124 |
|
| 125 |
|
| 126 |
|
| 127 |
|
| 128 |
|
| 129 |
|