唐文魁(1985-), 男, 湖南永州人, 博士研究生, 主要从事河流碳循环与全球变化研究. E-mail: tangweikui@qq.com
河口区是联系大气圈、岩石圈、水圈和生物圈的重要枢纽。厘清河口区碳的行为机理, 特别是二氧化碳(CO2)在水—气界面的交换过程, 有助于提高对近海碳源汇格局的认识。通过总结河口CO2水—气交换的国内外最新进展, 得出如下结论:①不同河口水体二氧化碳分压(
Estuary holds a key position in linking the four geo-spheres, i.e., atmosphere, lithosphere, hydrosphere and biosphere. Figuring out the transfer mechanisms of estuarine carbon, especially the exchange of CO2 at the air-water interface is conducive to understanding the carbon pattern in coastal oceans. So far, many fruitful studies have been conducted on the control mechanism towards the partial pressure of CO2 (
水圈作为一个巨大的碳储库, 在全球碳循环中发挥着关键作用。河口处于陆海交互作用强烈的地带, 是陆源物质进入海洋的最后环节, 同时也是连接地球四大圈层(大气圈、岩石圈、水圈和生物圈)的重要枢纽[ 1]。河口往往是物质和能量交换最频繁和受人类干扰最显著的地区, 强烈地影响着陆源物质进入海洋的输出通量, 发挥着化学反应器和过滤器的作用。
目前普遍采用的河口定义多是Pritchard[ 2]基于盐度给出的, “河口是一个半封闭的海岸水体, 它与外海自由相通, 其中的海水被来自陆地径流的淡水明显冲淡”。依此定义, 河口就是淡咸水相互混合和作用的区域[ 3]。虽然该定义并不完整, 但却构成目前国内外学者研究河口生物地球化学过程的基础。前苏联学者萨莫依洛夫[ 4]根据河、海的动力条件, 将河口区自上而下划分为近口段、河口段、口外海滨段3个不同的区段。其中河口段的径流与潮流两种过程转换不定, 水流水位呈周期性变化, 动力条件与河槽演变复杂, 是河口水文研究的关键区域;近口段仅表现为单一流向的径流, 但受潮汐的影响使得水位周期性升降;口外海滨段是径流作用逐渐消弱的近岸海域。河口的类型划分以Pritchard的自然地貌分类最为著名, 将河口分成溺谷、峡湾、砂坝、构造河口4个类别[ 5, 6]。近来Dürr等[ 7]基于地理信息系统提出了一个空间较为明确的河口类型划分方案, 包括小三角洲型、潮汐型、潟湖型、峡湾型4种类型, 同时也获得比先前更详细和精确的河口面积数据。
早在20世纪60年代, 河口表层水体二氧化碳(CO2)过饱和的现象就已被发现。河口的CO2释放问题随即被提出。然而, 已往研究主要侧重于陆源物质在河口的横向输送, 直到最近十几年, CO2在河口水—气界面交换过程才受到重视。河口是径流和潮流交换频繁的高度动态变化系统, 水—气界面CO2交换通量变化非常显著, 构成全球大气碳的源/汇平衡的重要组成部分, 源/汇演变的空间顺序可以简单地表示为“弱源”(河流)→“强源”(河口)→“汇”(海洋)[ 8]。河口水体碳的转变过程复杂, 生源要素在河口的行为变化、水体的驻留时间、潮流潮汐过程以及地下径流的排入等都会对河口碳循环以及CO2水—气交换通量产生影响。一方面, 河口段受潮汐和径流双重作用, 水体滞留时间及循环周期较短, 陆源物质由于水动力条件的改变, 其理化性质均不稳定;另一方面, 随着淡咸水的混合, 河流通过河口向近海输入大量的有机质和营养盐, 浮游生物光合作用和细菌的呼吸作用共同存在, 吸收和释放CO2的能力取决于两者的平衡。因此, 研究河口区内部各种碳组分的性质变化以及碳运移规律是估算河口碳通量的基础, 是解析流域—河口系统碳转换机理的重要环节。
2.1河口CO2水—气交换时空分异
在多数研究中, 河口水体被认为是大气CO2显著的碳源。Borge等[ 9]汇总了全球62个河口的CO2水—气通量资料, 仅非洲Aby潟湖表现为大气CO2的汇。这主要因为Aby潟湖长期盐度分层, 同时有机质运移到密度跃层以下, 使得水体能封存CO2[ 10]。河口与其他沿海系统相比, 其表层水体 pCO2空间递变和季节变化剧烈, 在400 ~ 9500 μatm之间[ 11~ 15]。
Chen等[ 16]基于全球106个河口数据, 提出了全球河口水体 pCO2的一般模式。一般来说, 在盐度S<2的河口上游段 pCO2值最高, 随着盐度的增加向下游降低。河口上游河道狭窄, 水流速度较快, 能搅动底层悬浮物, 从而降低了光合作用的效率。同时, 河流自身以及河口周围湿地随潮流携带的高 pCO2水体流入河口, 使得河口上游 pCO2偏高。盐度2
总体来看, 全球河口区CO2释放通量季节变化明显, 秋季(9~11月, 73.2 ± 93.4 mol/(m2·a))最高, 依次为夏季、春季, 在冬季(12~2月)最低(53.4 ± 65.1 mol/(m2·a))[ 16]。但由于全球各个河口地理位置不同, 流域下垫面条件(土壤、岩性、覆被和土地利用)、水动力条件及人类活动强度均有差异, 因此不同河口具体 pCO2季节变化各异。Jiang等[ 17]对比了北美3个河口系统 pCO2季节变化机制, 其中河流控制为主的Altamaha河口水体 pCO2和CO2水—气通量与河流流量变化相一致;而在湿地为主的Sapelo湾和Doboy湾CO2释放通量受控于季节温度变化, 6月和9月温暖的月份较高, 冬季和春季最低。Guo等[ 18]对珠江口 pCO2的研究表明, 珠江口上游(黄埔水道)春、夏季的 pCO2比秋、冬季高, 除受到径流量季节变化的影响外, 广州周围相对集中的点源输入导致的微生物好氧呼吸和硝化作用也有重要影响。
2.2河口CO2水—气通量估算
近年来对全球河口区及近岸海洋CO2水—气通量的研究成果逐渐增加。结果表明, 虽然全球河口区面积只有大陆架的4%(1.1 × 106 km2), 但其CO2水-气释放通量却相当于整个大陆架海域的CO2吸收量[ 19]。Frankignoulle[ 12]与Borges[ 13]对欧洲河口研究表明, 其水—气CO2释放通量约50 mol/(m2·a), 占欧洲陆地生态系统CO2吸收量的33%~50%, 相当于西欧地区人为CO2排放量的5%~10%[ 20]。最近对中国两大河流河口——珠江口和长江口的研究表明, 珠江口和长江口CO2释放通量分别约为6.92 mol/(m2·a)和25 mol/(m2·a)[ 18, 21, 22], 与Borges 等[ 23]估算的低纬度(0~30°)和中纬度地区(30~60°)河口CO2平均释放通量相比明显偏低。这可能是因为这些大河水体总碱度(TA)较高[ 24], 碳酸盐体系缓冲能力较强, 相对释放到大气的CO2较少。
Borges等[ 11, 23]于2005年第一次对全球河口所有可获得的CO2通量数据进行了整理, 他们得出了全球河口CO2的水—气交换通量总值高达0.50×1015g C/a, 与河流DIC的入海通量相当。其后, Laruelle等[ 25]在Borges 等的基础上对全球河口CO2水—气交换通量重新进行了估算, 得到的结果是(0.27 ± 0.23)×1015g C/a。而Cai[ 19]考虑到一些大河河口和海湾具有较低的 pCO2值, 认为全球河口CO2水—气交换通量可能会进一步降低, 给出了(0.25 ± 0.25)×1015g C/a的通量值。显然, 目前全球河口CO2水—气交换通量估算依然有明显的不确定性。IPCC在2007年的第四次气候变化评估报告中提到, 全球河流每年向海洋输送的碳约0.8×1015g C/a[ 26], 那么根据以上估算, 至少有1/3的碳经过河口时被释放到大气中。
有机碳输送到深海大洋前, 在河流、河口和大陆架等水体的循环机制目前仍然存在着争议。河流每年向海洋输送大约0.46×1015g的陆源有机碳[ 27], 其中溶解有机碳(DOC)足以维持整个海洋中DOC的循环, 颗粒有机碳(POC)通量相当于目前海洋沉积物中有机碳的总量, 但生物标志物和稳定碳同位素的证据表明, 海水中有机质主要来自海洋自生产物[ 28, 29]。这说明陆源有机质在河口淡咸水混合过程中, 必然经历了复杂的转化或快速的去除过程。
河口是典型的净异养系统, 表现为系统总初级生产力(GPP)要小于群落呼吸消耗(CR)。有机质在河口的矿化过程被认为是维持其CO2高释放通量的一个重要原因。河流能携带大量的活性有机质, 同时河口周围盐沼、红树林和湿地等沿海生态系统具有很高的生产力, 为河口微生物的呼吸降解提供了充足的基质。而在多数河口系统中, 由于水流流速较快以及浊度较高, 尽管有足够的营养物质, GPP依然受到限制。事实上, 河流向河口输入的氮(N)和磷(P)大部分(分别为62%和90%)是以溶解和颗粒态有机质的形式存在[ 30]。陆源有机质C/N和C/P比值高于河口原地生成有机质的比例。因此, 陆源有机物在河口的矿化过程能承受较大的碳需求(提高CR), 同时释放相对较低的N、P以维持GPP。Smith等[ 31]研究表明, 随着河口CR净异养增加, GPP也会随之增加, 他认为这是由于微生物降解有机质的同时, 亦能释放营养元素提高GPP。
河口微生物的好氧呼吸作用能够同时在水体和沉积物中进行。河口的低盐度水环境和颗粒物表面丰富的有机质适合于微生物的滋生繁衍, 而微生物的呼吸作用促进了有机质的降解, 可使颗粒物中有机碳的含量明显减少, 转化为无机碳。陆源有机碳组成还将影响到河口区的生物地球化学过程。对水体中DOC和POC的同位素组成研究表明, 虽然“年轻”的DOC进入水生生态系统可被优先矿化降解[ 32], 但同时“老”有机碳的降解也占了很大比例[ 33]。由于河流、沿海湿地和红树林等系统可输送各种来源、年龄和反应性质的有机质, 因此在辨别有机碳(OC)的来源以及控制OC矿化的因素等方面仍有许多问题亟待解决。
全球河口区如此高的CO2水—气交换通量似乎表明, 大部分陆源有机质在经过河口传输过程中都被呼吸降解掉了。但早期研究表明, 只有10%~50%的河流DOC在河口被消耗掉[ 34~ 36], 但河口释放的CO2净通量往往等于或大于其有机碳的载荷。Chen等[ 37]援引了Keil等[ 38]对亚马孙河的研究, 表明亚马孙河70%的POC通过分解为河口CO2脱气提供了充足的碳源。而Cai[ 19]认为无论河口CO2脱气速率是否被高估, 由于河流水体在河口区驻留时间很短, 强烈的呼吸降解过程不应该发生这里。同时光降解作用、河口细菌对水体自生有机碳的耗氧呼吸作用、淡咸水混合过程中淡水对海水的酸化作用等, 都不足以支持河口如此高的 pCO2。相反, 陆源有机质可能主要在近海, 特别在陆架区被降解掉的。
Cai[ 19]认为河口逸散到大气的CO2, 可能部分来源于潮水定期冲刷沿岸湿地携带过来的降解产物。一般来说, 水生环境下微生物分解有机质速率远低于氧气(O2)和CO2水—气交换速率[ 39, 40]。但由于湿地等生态系统较高的植被覆盖, 低风速条件下导致较低的气体交换率, 微生物的代谢信号(低O2和高的 pCO2)在水体中仍能够“保持”下来, 然后通过潮流传输到河道干流及河口, 这时CO2水—气交换可以快速发生。即河口逸散的CO2在湿地生成, 然后运到河口, 在河口驻留期间流失到大气中, 而同时水体DOC和溶解无机碳(DIC)含量没有较大的改变[ 17, 41, 42]。Cai等[ 39]还描述了一个温带湿地为主的河口碳循环模型, 潮间带湿地沉积物的矿化过程, 以及无机碳在涨潮时通过孔隙水的运动扩散进行交换, 能有效解释潮沟水体中明显的异养特征。Cai等[ 14]对北美Satilla河口研究也表明, Satilla河口逸散的CO2几乎都来自河口周围盐沼微生物呼吸所生成的CO2。同时由于水体较长的驻留时间(2个月)、较低的碱度(200~500μmol/L), Satilla河口CO2逸散到大气的通量超过了河流DIC通量约10倍。Chesapeake湾[ 43]和南非盐沼河口[ 44]也有类似机制的报道。
除了上述的驱动力以外, 河口CO2净通量还进一步被额外的生物地球化学过程调节, 例如碳酸钙的沉淀/溶解过程。然而, 目前对河口环境CO2系统碳酸钙沉降/溶解的影响少有报导。在沉积物中, 由于代谢驱动氧的消耗使得孔隙水酸化会导致碳酸钙溶解。Abril等[ 45]采用化学计量和矿物饱和指数的方法, 评估法国的Loire河口低盐度区生物呼吸和碳酸盐溶解之间的耦合关系, 表明异氧呼吸所产生20%的CO2参与了碳酸盐溶解, 导致水体DIC增加。Neal等[ 46]在研究英国Tweed河、Great Ouse河和Thames河碳酸钙饱和度的影响因素时, 认为地下水的输入和光合作用的增强导致水体CO2含量下降、pH升高, 使水体中的碳酸钙达到过饱和状态而发生沉降。张向上等[ 47]于2004年、2006年间发现黄河口低盐度区水体存在DIC亏损和pH异常增高的现象, 分析认为碳酸盐矿物的沉降作用是造成DIC亏损原因之一。此后, 刘志媛等[ 48]对黄河口无机碳的研究也发现类似现象。
但研究表明, 水体中碳酸钙达到过饱和状态并不一定会引起碳酸钙沉淀, 溶解活性磷酸盐(SRP)和DOC的含量会对碳酸钙沉淀起抑制作用。高浓度的SRP可以抑制碳酸钙晶核的形成;DOC过高则影响碳酸钙沉降的动力学系数[ 49]。由于河口水体的理化参数变化剧烈, 使用碳酸盐饱和度表示河口的碳酸钙沉淀/溶解往往受到限制。目前还可通过河口混合过程中ΔDIC和ΔTA的关系来表征河口无机碳的沉淀/溶解过程, 即单纯的碳酸钙沉淀/溶解可以引起ΔDIC和ΔTA的比率为1:2。
目前, 水—气界面的CO2交换通量大都基于静滞层模型来估算, 公式如下:
F = k × α × Δp
 | (1) |
式中, F是水—气界面CO2交换通量, α是某温压条件下CO2溶解度, Δp是水—气界面间 pCO2差值, k是CO2气体传输速率。以上几个参数中, α可使用Weiss公式计算得出, pCO2测定技术也得到不断完善, 但气体交换速率 k的估算依然争议很大, 给水—气CO2通量估算带来很大的不确定性。
k值的大小主要取决于液相边界层的湍流[ 50]。在一般天然水体环境中, 风是产生湍流最常见的驱动因素, 因此多数研究常将 k看作风速的函数来计算河口的气体通量[ 51]。但实际过程中, 河口水动力变化导致的水流摩擦亦能加强边界层湍流。Raymond等[ 52]对比了不同的水体环境, 发现在相同的风速条件下, k在河口要比在湖泊和海洋显著偏高。Zappa等[ 53]对Plum湾研究发现, 在低风速(1.9 m/s)条件下, k、潮流流速和边界层湍流度存在很好的相关性。Borges等[ 54]使用FC法(Floating Chamber)对欧洲3个河口(Scheldt河口、Thames河口和Randers河口)的 k进行了测量, 2个强潮河口(Scheldt河口和Thames河口)的 k值明显要比弱潮河口(Randers河口)高得多。其中Scheldt河口的水流摩擦对 k贡献约占24%, 剩余76%归因于风力驱动[ 55]。
此外, Abril 等[ 56]发现水体悬浮物较高时(TSS > 0.2 g/L), 具有衰减湍流的作用, 进而提出一个河口通用的经验公式。其中 k作为水流速度、风速、河口表面积和TSS浓度的函数, 公式如下:
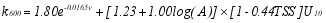 | (2) |
式中, k600是施密特常数校正到600时气体传输速度(cm /h), A是河口的表面积(km2), v是流速(m/s), TSS是总悬浮固体(g/L), U10是10m高度的风速(m/s)。
除了上述影响 k的诸多因素外, 其他因素如气泡、波浪扬程和降雨等也对其有影响[ 57]。但目前为止, 还没有满意方法以实现 k值在河口的量化。迄今大部分研究是采用FC法测量 k值[ 9]。FC法具有操作简便和响应较快的优点, 能在短时间内充分描述在风和水流的推动下 k值随时间的变化。但FC法也存在一些问题, 比如在高风速的情况下, 浮箱相对水面移动, 破坏液相边界层, 人为地提高气体交换。目前, 微气象技术也被引入到水—气通量的研究中, 但它们在河口系统的应用目前还有困难。
5存在的问题及展望
目前河口水-气界面的碳交换过程的研究依然存在着研究深度有限、区域代表性不够等问题。河口CO2水—气通量的研究大多集中在欧洲、亚洲和北美东部海岸。在低纬度和高纬度地区, 河口数据存在缺失。全球河流输送的有机碳和无机碳>60%被携带到低纬度地区[ 58], 但目前仍缺乏对低纬度河口碳的来源、通量和转化的数据。高纬度地区(>65°N)潟湖型与峡湾型河口分布广泛, 但在已有的河口数据中, 这2种类型河口的数据极少。因此未来仍有必要提高在河口CO2通量研究的空间覆盖。
目前, 全球及不同类型河口的CO2释放通量, 主要是根据每种河口类型的平均CO2通量及表面积在全球范围内缩放得出的[ 59]。但全球河口面积的估算还存在很大的不确定性。Woodwell等[ 60]于1973年将美国河口面积与海岸线长度比例外推到全球, 得到全球河口面积。考虑到全球河口差异性, 这是一个非常粗略的近似估算。虽然针对单个河口区域已有丰富和详细的地理信息资料, 但目前却没有全球以及不同类型河口统一的数据信息[ 19]。
近十几年来, 随着人们对河口在全球碳循环中的作用和地位的不断重视, 河口CO2研究普遍开展起来, 同位素示踪、有机物组成分析、光谱分析和超高分辨质谱分析等技术的应用推动了河口碳循环研究的快速发展[ 61, 62]。但在已有研究中, 较少考虑潮流过程、各种风力混合和水柱分层的影响, 河口CO2交换模型构建、碳转换过程研究以及系统的综合性研究明显不足。同时, 由于流域内土地利用的变化以及建坝为主的水利开发, 极大地影响了流域-河口系统的水循环和物质输送, 未来也有必要对河口环境进行持续监测, 以阐明河口水体 pCO2及水—气CO2通量年际变化和长期趋势。此外, 通过不同类型的河口对比, 深化河口水体 pCO2控制机制, 提高河口CO2水—气通量估算精度也将是未来河口CO2水—气交换研究的重要方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|


